 Nel 2010, in Italia, le vendite di medicinali senza obbligo di prescrizione sono state circa 318 milioni di confezioni, con una flessione del 3,8% rispetto all'anno precedente, per un giro d'affari di 2.212 milioni di euro (+0,4%). Lo ha reso noto Anifa, l'Associazione nazionale dell'industria farmaceutica dell'automedicazione aderente a Federchimica, sottolineando che sulla contrazione delle vendite ha inciso il ritardo, rispetto alle previsioni, della stagione influenzale.
Nel 2010, in Italia, le vendite di medicinali senza obbligo di prescrizione sono state circa 318 milioni di confezioni, con una flessione del 3,8% rispetto all'anno precedente, per un giro d'affari di 2.212 milioni di euro (+0,4%). Lo ha reso noto Anifa, l'Associazione nazionale dell'industria farmaceutica dell'automedicazione aderente a Federchimica, sottolineando che sulla contrazione delle vendite ha inciso il ritardo, rispetto alle previsioni, della stagione influenzale.
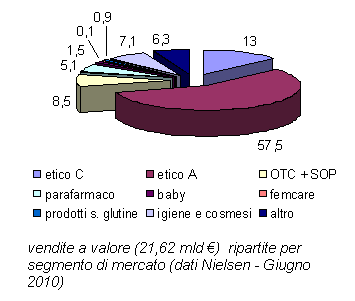
Dalla diagramma a fianco, si evidenzia come il mercato di SOP e OTC, oggetto della liberalizzazione, rappresenti l'8,5% del mercato totale dei farmaci, per un fatturato di 1,84 miliardi di Euro. Il segmento relativo invece ai farmaci di fascia C (che richiedono la prescrizione medica ma non sono ammessi a rimborso da parte del sistema sanitario nazionale), ha un peso del 13% e un fatturato pari a 2,81 miliardi di Euro.
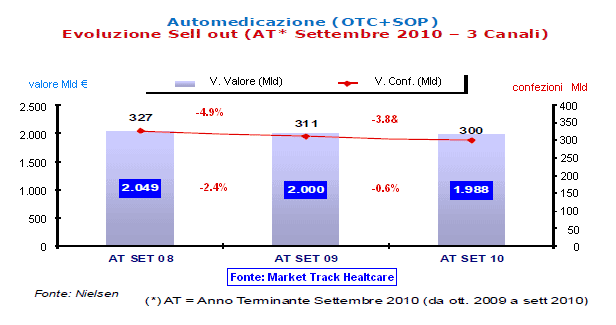
Dalla tabella sotto riportata si rilevano le dinamiche del mercato negli ultimi tre anni. Come si può notare, non si è verificato un aumento dei consumi. Si rileva inoltre come la quota di mercato acquisita dal settore della GDO (Grande Distribuzione Organizzata) è di circa il 3%.

La disciplina attualmente vigente prevede che la vendita di farmaci da banco (SOP e OTC) avvenga in aree dedicate (la cui regolamentazioene è affidata alle Regioni) e in presenza di un farmacista. Sebbene la struttura richiesta per trattare questi farmaci sia del tutto paragonabile in termini di tutela della salute ad una farmacia, la vendita è
circoscritta ad una parte minoritaria di farmaci.
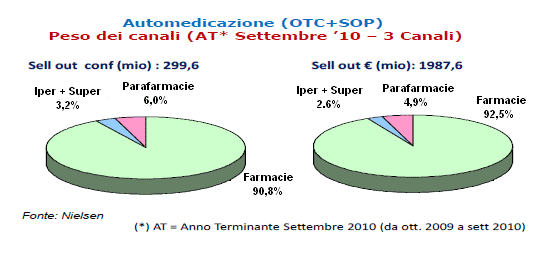
Dunque, la farmacia, nonostante i prezzi mediamente più alti, mantiene la sua leadership; tuttavia, le dinamiche di sviluppo sembrano premiare maggiormente i competitors in quanto le parafarmacie (erano 2.790 i negozi di questo tipo alla fine dell'anno) hanno aumentato le vendite a valore nel 2010 del 13,5%, i corner della Gdo (284 punti di vendita) hanno incrementato del 5,4% e le farmacie, il segmento più maturo, con il 3,9% hanno ottenuto l'incremento più basso.
Dal processo di parizle liberalizzazione del mercato dei farmaci avviato nel 2006, si può ritenere che la diffusione dei medicinali nei corner della GDO e nelle parafarmacie sia ormai stabilizzata e definita nella tipologia e consistenza il volume d'affari. D'altro canto, il secondo elemento di erosione del canale farmacia, la distribuzione per nome e per conto (Dpc), iniziata coinvolgendo poche selezionate molecole ad alto costo, con la pressione del controllo sulla spesa parzialmente passata all'àmbito regionale ha registrato negli ultimi anni un incremento costante. Questo elemento, unito alla periodica ripresa da parte di organi di informazione di possibili scenari di liberalizzazione che potrebbero ulteriormente ridimensionare il ruolo della farmacia nella distribuzione territoriale, porta a domandarsi quanto veramente tale evoluzione sia un fatto reale, come si sia modificato il giro d'affari nel recente passato e quanto ci si può attendere nei prossimi anni.
Nell'anno 2010 le oltre 17.500 farmacie italiane hanno prodotto un giro d'affari che ha sfiorato i 26 mld di euro (i datri del diagramma Nielsen si riferiscono a Giugno 2010) con la crescita del 1,6% rispetto all'anno precedente. Questo importo è stato il frutto della vendita di quasi 2,5 miliardi di confezioni ai cittadini, che hanno incrementato i loro consumi del 1,2% nel canale. I dati consuntivi di IMS HEALTH presentano, quindi, un mercato in farmacia in positivo progresso anche se i tassi di sviluppo ad unità e valori sono stati alquanto modesti, segno del perdurare di una crisi che non è ancora giunta al termine.
La quota di mercato dei farmaci con obbligo di ricetta è stata pari al 66,6% del valore complessivo del mercato con un progresso dello 0,5% mentre le unità vendute sono cresciute del 2,2% complice un prezzo medio in evidente calo (-1,7%) dovuto essenzialmente all'ulteriore riduzione dei prezzi delle specialità rimborsabili (Classe A). I farmaci d'automedicazione, che perdono il 4,3% delle vendite a unità e lo 0,1% a valori coprono il 7,9% del mercato e sono superati dagli altri prodotti da banco non registrati che rappresentano l' 8,6% e hanno i tassi di sviluppo più importanti poiché i consumi sono saliti del 6,2% e la spesa del 10,1%.
Perdura la crisi del settore dietetico i cui consumi flettono del 2,7% e la spesa dello 0,8% a fronte di prezzi in leggera crescita (+1,9%). Continua, invece, il trend positivo del mercato parafarmaceutico che migliora sensibilmente a valori( +4,4%) accontentandosi di chiudere l’anno con un incremento dei consumi unitari sotto il punto percentuale, mentre i prodotti per l’igiene e cura della persona denotano qualche difficoltà nelle vendite a volume (-0,4%) ma mostrano un accettabile sviluppo a valori( +2,4%) grazie ai prezzi medi in crescita (+2,9%).
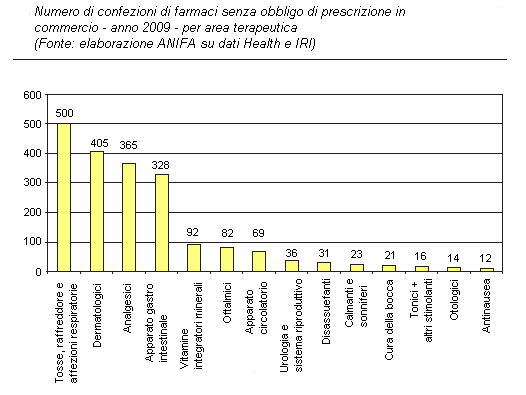
Continuando l'esame delle classi terapeutiche si nota una certa discontinuità dei segni: a volumi si evidenzia la flessione dei farmaci per l'apparato respiratorio (-0,2%) e degli antibiotici(-3,9%), ai quali si aggiungono i prodotti per l'apparato muscolo-scheletrico, gli antitumorali e i dermatologici. Allo stesso tempo crescono, però, i consumi dei genito-urinari(+1,6%) degli ematologici(+2,5%) e degli ormoni non sessuali( +2,9%), mentre più contenuti sono i guadagni dei prodotti per gli organi di senso.
A valori si deve rimarcare il netto cedimento degli antibiotici( -7,6%) dovuto oltre alla flessione della domanda anche alla scadenza brevettuale di azitromicina registrata nel 2009; positivo, al contrario, l'andamento della spesa per i farmaci per l’apparato respiratorio e muscolo-sheletrico, e degli oftalmici e otologici. In generale l’evoluzione dei farmaci rimborsati rispecchia il trend della spesa Ssn che nonostante l’evoluzione positiva della domanda si conferma in declino come conseguenza di una netta riduzione dei rimborsi per ricetta effetto combinato dei tagli prezzi sui farmaci generici, di importanti scadenze brevettuali in ambito primary care e interventi regionali di controllo prescrittivo.
Bassa incidenza di patologia ma anche costante espansione dell'impiego dei generici spiegano gli andamenti contraddittori che abbiamo appena visto: anche nel 2010 alcune importanti molecole hanno perduto la copertura brevettuale tanto che un prodotto su tre venduto nell’anno era un off-patent. In virtù dei prezzi inferiori, la quota di mercato a valori dei generici( dato importante perché ha implicazione diretta sul contenimento della spesa farmaceutica) è arrivata al 17,2%. I farmaci generici o equivalenti sono ormai parte integrante di tutte le classi terapeutiche con quote che vanno dal 40% circa tra gli ormoni non sessuali al 4,2% tra gli antitumorali. Nelle classi più importanti il contributo degli unbranded è vicino al 12% tra i cardiovascolari, raggiunge il 20% nel sistema nervoso, ed è consistente anche nei gastro-metabolici, nell’apparato respiratorio e negli antibiotici. L’assorbimento scende al 11,6% nei genito-urinari ma risale nell’apparato muscolo-scheletrico(25,8%) e nella classe di ematologici(23,7%). Il dato di maggiore rilevanza riguarda comunque l’andamento tendenziale dei generici: con la sola esclusione dell’apparato respiratorio ( - 6,5%) e dei dermatologici(-1,7%), questi prodotti sono in crescita generalizzata su tutta la linea, con tassi di sviluppo particolarmente significativi nelle aree del cardiovascolare(+12,3%), dell’apparato digerente e metabolismo(+12,5%), dei genito-urinari(+11,4%) e degli oftalmici e otologici(+13,2%). Ovviamente, negli anni a venire, l’impatto dei generici sull’economia del mercato dei farmaci con ricetta è destinato ad aumentare sempre di più, stante il fatto che giungeranno a scadenza molti altri brevetti, permettendo un progressivo allineamento del nostro paese alle realtà già da anni presenti in molti altri paesi europei. In particolare le previsioni sul periodo 2011-2015 calcolano l’effetto calmierante sui valori nel canale farmacia dovuta alle scadenza brevettuali come l’elemento più importante con impatti attorno al -1,5% annuo solo parzialmente bilanciato da nuovi lanci e aumento prezzi(IMS MARKETI PROGNOSIS 2011-2015).
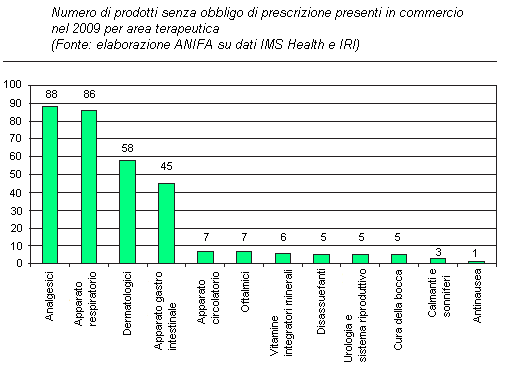
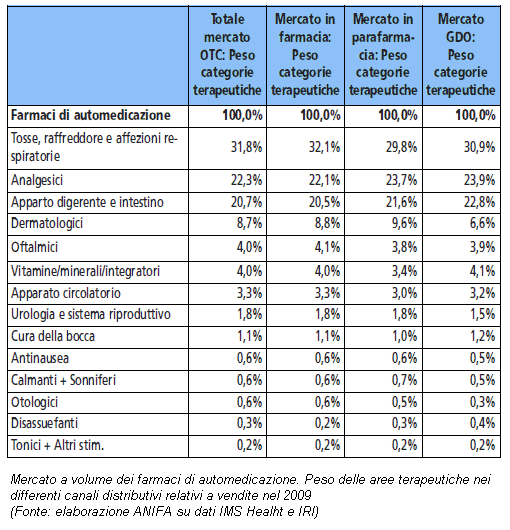 Nel 2009, il volume d’affari prodotto dalla vendita di 966 milioni di confezioni di prodotti non soggetti all'obbligo della prescrizione medica è stato di 8,7 mld di euro. Questo segmento di mercato è composto da 4 settori merceologici dei quali il più importante è rappresentato dai prodotti OTC che ha generato vendite per oltre 4,2 mld di euro ed ha avuto, nel suo complesso, un progresso del 4,8% a valori che, d'altra parte, è essenzialmente dovuto agli aumenti dei prezzi: questo fatto ha avuto influenza sul calo dei volumi che è sceso, rispetto al 2009, di oltre mezzo punto percentuale.
Nel 2009, il volume d’affari prodotto dalla vendita di 966 milioni di confezioni di prodotti non soggetti all'obbligo della prescrizione medica è stato di 8,7 mld di euro. Questo segmento di mercato è composto da 4 settori merceologici dei quali il più importante è rappresentato dai prodotti OTC che ha generato vendite per oltre 4,2 mld di euro ed ha avuto, nel suo complesso, un progresso del 4,8% a valori che, d'altra parte, è essenzialmente dovuto agli aumenti dei prezzi: questo fatto ha avuto influenza sul calo dei volumi che è sceso, rispetto al 2009, di oltre mezzo punto percentuale. A valori, complice l'aumento dei prezzi, i segni negativi si limitano ai prodotti per l'apparato respiratorio(-1,2%) mentre le altre classi di rilevante importanza sono tutte in crescita. In consumi di parafarmaci hanno avuto uno sviluppo rallentato nel 2010 e la crescita a volumi si è arrestata allo 0,8%; meglio è andata a valori che, anche grazie ai prezzi medi in aumento del 3,6%, registrano una crescita del 4,4% rispetto al 2009.
Con oltre 120 milioni di confezioni vendute i prodotti salutistici hanno conquistano la fiducia di un italiano su tre e la loro crescita sembra inarrestabile. Gli integratori alimentari costituiscono un segmento di mercato degli alimenti; in particolare, comprendono una vasta serie di prodotti, dai fermenti lattici alle vitamine, dai complementi alimentari per sportivi ai dimagranti.
Sommando anche i 6 milioni acquistati nelle parafarmacie e gli introiti delle erboristerie, l'intero indotto generato dal settore dei prodotti salutistici si attesta a 1.453 milioni di euro, con un incremento del 4,2% rispetto al 2007 nelle vendite nella grande distribuzione e un +8,7% nelle vendite in farmacia (Fonte Ac/Nielsen per FederSalus).
1- Ampliamento dei farmaci vendibili in presenza del farmacista: i farmaci Senza Obbligo di Prescrizione (SOP) sono farmaci a tutti gli effetti (come quelli soggetti a prescrizione) anche se dispensabili senza ricetta medica. Ciò per via dei bassi dosaggi in essi contenuti o perché utilizzati per patologie di lieve entità. Tuttavia, considerato che tali farmaci (SOP) contengono spesso lo stesso principio attivo - anche se in dosi inferiori - di quelli venduti solo con ricetta, si ritiene utile la presenza di un'adeguata figura professionale, il farmacista, che possa consigliare gli acquirenti, in modo da accertare le eventuali interazioni o controindicazioni derivanti dall’assunzione del farmaco.
E’ però evidente che nel momento in cui in un esercizio siano presenti tutte le garanzie ed i presidi necessari (tramite la presenza del farmacista), sarebbe opportuno (ed anzi auspicabile) un incremento dei farmaci vendibili nella GDO, poiché si fornirebbe un servizio migliore alla collettività e si valorizzerebbero le figure professionali che lavorano all'interno dei punti di vendita.
La proposta di Federdistribuzione è quindi quella di ampliare la categoria dei farmaci vendibili con presenza del farmacista aggiungendo, agli attuali SOP e OTC, anche quei farmaci di fascia C che per principi attivi e per caratteristiche specifiche risultano analoghi a tutti gli effetti ad altri farmaci già ricompresi nella categoria dei SOP (ciò anche tramite inclusione dei farmaci di fascia C aventi le caratteristiche di cui sopra nella categoria SOP).
2. Vendita dei farmaci OTC senza obbligo del farmacista: per quanto concerne la vendita di farmaci OTC (dall'inglese Over The Counter, vicino alla cassa, o per analogia "farmaci da banco"), va innanzitutto rilevato come si tratti di medicinali che per la loro composizione ed il loro obiettivo terapeutico sono concepiti per essere utilizzati anche senza l'intervento del medico sia per la diagnosi che per la sorveglianza nel corso di trattamento, e possono essere richiesti direttamente dal paziente. Infatti, i farmaci OTC sono destinati a porre rimedio a piccoli disturbi: ricostituenti, lassativi, vitamine, antiacidi, antiemorroidali, antinfiammatori, colliri ecc.
Devono per questo possedere alcuni requisiti fondamentali:
a- contenere principi attivi già largamente impiegati in medicina (la loro immissione in commercio non può essere inferiore a 5 anni CORREGGERE 5)
b- essere destinati a disturbi o sintomi di facile valutazione da parte dello stesso paziente
c- avere confezioni di volume ridotto e per terapie di breve durata.
Senza voler diminuire il ruolo professionale del farmacista, che può fornire ogni ulteriore spiegazione o chiarimento sul farmaco, è peraltro evidente come gli OTC siano farmaci che potrebbero essere gestiti e distribuiti anche senza la presenza di un farmacista, così come avviene in molti altri Stati del mondo. Sulla scarsa valenza farmacologia di tali prodotti si ricorda che i farmaci OTC sono gli unici per i quali è consentita la pubblicità direttamente al pubblico, tramite i mass media.Si rileva inoltre come i farmaci OTC siano venduti a self service anche in farmacia (sulla base di quanto previsto dall'articolo 9 bis della legge del 16 novembre 2001, n. 405).
commento: la liberalizzazione della vendita dei farmaci di classe C è condivisibile giacché è manifestamente illogico che un farmacista iscritto all'Ordine possa esplicare la sua attività di controllo e vendita unicamente in farmacia (sarebbe come se un medico iscritto all'Ordine potesse esercitare la sua attività prescrittiva solo in ospedale). Per contro, la richiesta di completa liberalizzaione degli OTC non sembra accettabile; anzi, deve essere rigettata. La motivazione è semplice: la commercializzazione dei farmaci OTC richiede l'autorizzazione (AIC) dell'Aifa in quanto sono medicinali e come tali possono avere una indicazione terapeutica unitamente alla corretta posologia. Il fatto è che gli integratori alimentari, sono "spesso e volentieri" proposti con una package che ricorda il medicinale di automedicazione. Però non è così: gli integratori alimentari, a loro volta confondibili con prodotti alimentari che non sono integratori alimentari, non possono avere una indicazione terapeutica ma unicamente dei consigli salutistici uniti a consigli per la loro assunzione. La liberalizzazione degli OTC immediatamente aumenterebbe la confusione, particolarmente se venissero posti sullo stesso scaffale deglli integratori o su quello accanto. Così, avremmo due categorie pericolosamente sovrapposte: i medicinali, il cui controllo di qualità e sicurezza è garantito dall'Aifa e gli integratori alimentari, per la cui commercializzazione è sufficiente la notificazione al Ministero della Salure, infine gli pseudo integratori che pur proposti in confezioni che ricordano il medicinale, sono alimenti e punto.
|
Le
farmacie nei principali Paesi dell'Europa: una rete di distribuzione capillare.
|
|
|
|
|
Dagli inizi degli anni '90 l'industria farmaceutica europea ha perso competitività rispetto a quella Usa, che continua a crescere in termini di capacità innovativa e di investimenti nella ricerca.
Molteplici sono gli indicatori di questo divario:
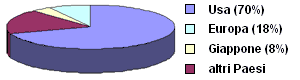 vendite di nuovi farmaci lanciati nel periodo 1998-2002 per aree geografiche (Fonte: IMS Health, 2003) |
I farmaci detti "orfani" sono destinati alla cura delle malattie talmente rare che i produttori sono poco disposti a diffonderli nelle condizioni abituali di commercializzazione.
Il processo che parte dalla scoperta di una nuova molecola fino alla sua commercializzazione, è lungo (in media 10 anni), costoso (diverse decine di milioni di euro) e molto aleatorio (tra dieci molecole testate, una sola può avere effetto terapeutico). Diffondere un farmaco destinato al trattamento di una malattia rara, o comunque presente in mercati economicamente insolvibili, non permette di recuperare il capitale investito per la sua ricerca.
Il farmaco orfano è un farmaco non diffuso dall'industria farmaceutica per ragioni economiche ma che risponde ad una necessità di salute pubblica.
Concretamente possono presentarsi tre casi:
È stato intrapreso uno sforzo sia a livello nazionale che europeo dalle industrie e dalle autorità della salute (EMEA: European Agency for the Evaluation of Medicinal Products), al fine di offrire gli incentivi necessari per stimolare lo sviluppo dei farmaci orfani e l'ottenimento di una Autorizzazione alla commercializzazione (AMM) attraverso una procedura centralizzata.
L'obiettivo è quello di disporre rapidamente, per le patologie rare, dei farmaci con un livello di qualità equivalente a quello richiesto per qualsiasi altro farmaco.
Queste misure sono state adottate nei tre maggiori mercati farmaceutici.
![]() Stati Uniti
Stati Uniti
Le autorità responsabili della Salute pubblica hanno preso coscienza della necessità di una legislazione sui farmaci orfani dal 1983, con la firma dell'Orphan Drug Act. Questa legge definisce il "farmaco orfano" in rapporto alla frequenza della malattia per la quale è stato indicato come cura nella popolazione americana. Il concetto di farmaco orfano negli Stati Uniti non si limita ai soli prodotti farmaceutici o biologici, ma riguarda anche i dispositivi medici ed i prodotti dietetici. E' stato creato un "ufficio dei farmaci orfani" all'interno della FDA (Food and Drug administration): l'OOPD (Office of Orphan Products Development). Ha il cómpito di assistere ed incoraggiare la disponibilità dei prodotti sicuri ed efficaci per la cura delle malattie rare. Accordando ad un farmaco lo status di "orfano ", si permette al promotore (sponsor) di beneficiare degli incentivi per la diffusione di questi prodotti fino all'AMM, vero marchio di qualità. Queste misure si applicano a tutti gli stadi dello sviluppo del farmaco:
![]() Giappone
Giappone
Il Giappone ha seguìto gli Usa 10 anni più tardi: dopo il 1993, 125 farmaci hanno ricevuto lo status di farmaci orfani e 45 sono stati commercializzati.
![]() Europa
Europa
L'Europa, principalmente a causa del frazionamento del suo territorio e della dispersione delle competenze in materia sanitaria, ha tardato nell'adozione di una politica unica sui farmaci orfani. Dopo il 1° gennaio 1995, con il nuovo sistema di autorizzazione alla commercializzazione comunitaria valido per tutto il territorio, e la libertà di circolazione che ne consegue, l'Europa si può oggi considerare un territorio con una popolazione di 370 milioni d'abitanti, superiore a quella degli Stati Uniti dove però viene applicata una regolamentazione unificata.
Il 16 dicembre 1999, il Parlamento Europeo e il Consiglio hanno adottato il regolamento (CE) N° 141/2000 riguardante i farmaci orfani. Ampiamente ispirato dal regolamento degli Stati Uniti, i suoi obiettivi sono:
60 farmaci hanno ottenuto lo statuto di farmaci orfani, di cui 3 hanno ottenuto una AMM europea.
in Data 06 Settembre 2005 EMA (European Medicine Agency - prima EMEA, European Medicine Evaluation Agency), ha Pubblicato l'Elenco Completo dei Medicinali Orfani Autorizzati o Negati alla Classificazione di Medicinali Orfani.
L'EMA tramite il COMP (Comitato per i Medicinali Orfani) valuta le domande di assegnazione
della qualifica di farmco orfano inoltrate da persone e aziende che intendono sviluppare detti medicinali.
I Medicinali orfani Sono destinati alla Diagnosi, Alla Profilassi o alla Terapia di una affezione che comporta una minaccia per la vita o seriamente debilitante e rara e che colpisce non oltre 5
individui su 10.000 nell'UE.
L'industria Farmaceutica non è disposta a sviluppare detti medicinali alle normali condizioni
di mercato in quanto in mancanza di incentivi i costi della loro immissione sul nercato non sarebbero recuperati con le vendite previste. Per questa ragione l'UE concede alcuni incentivi:

I dati citati possono essere variati; per aggiornamenti si può far riferimento a questi due siti internet:
www.emea.eu.int (il sito ufficiale dell'EMEA)
www.orpha.net (sito dedicato alle malattie rare ed ai farmaci orfani)
Fonti : European Parliament 1999- STOA PUBLICATIONS- Orphan Drugs- PE 167 780/Fin.St.
Presentazione del Pr Josep Torrent-Farnell (presidente del COMP) all'Annual EuroMeeting 2001, Barcellona, 6-9 marzo 2001.
CU = uso compassionevole; NP = base nominativa del paziente; ATU = autorizzazione temporanea dell'uso prima della AMM |
A causa di differenze di legislazioni, la facilità e la rapidità d'accesso al farmaco orfano non è la stessa nei 15 Paesi d'Europa, come indicato nella tabella a destra.
| 11 | |||||||||||||||||
Marcello Guidotti, copyright 2003-2004-2005-2011
questa pagina può essere riprodotta su qualsiasi supporto o rivista purché sia citata la fonte e l'indirizzo di questo sito (ai sensi degli artt. 2575 e 2576 cc. Legislazione sul diritto d'autore). Le fotografie sono tratte da siti web e costituiscono materiale pubblicitario, oppure sono, o possono ritenersi, di pubblico dominio purché utilizzate senza fini di lucro.