tensioattivi
I tensioattivi generalmente denaturano irreversibilmente le proteine provocandone, anche a bassa concentrazione, la flocculazione. In generale, i tensioattivi ionici hanno azione battericida (variabile a seconda che agiscano su Gram+ o Gram-) ma non sporicida, mentre i non ionici, come i tweens (v. avanti), migliorano i terreni di coltura in quanto facilitano la distribuzione dei microbi. Tuttavia, è sconsigliabile utilizzare i tensioattivi come agenti microbici sistemici per la loro azione emolitica, anafilattica e per i danni renali che possono produrre.
L'azione dei tensioattivi viene sfruttata per aumentare la bagnabilità, la spandibilità, per stabilizzare sospensioni ed emulsioni. Le sostanze tensioattive variano l'angolo di contatto con una superficie solida, la tensione interfacciale con un altro liquido, l'indice di rifrazione (producendo opalescenza) e la viscosità.
azione sulla bagnabilità: l'acqua ha g = 72 dine/cm, ma con piccole concentrazioni (0.01%) di opportuni tensioattivi, può scendere fino a 20 dine/cm
azione sulla spandibilità: i tensioattivi vengono usati per preparazioni per uso topico, orali ed iniettabili (in questo caso vi sono controindicazioni: sono pirogeni, emolitici ed irritanti verso i tessuti, per cui si usa parenteralmente solo il tween).
dispersioni e tensioattivi: aspetti teorici
Quando due liquidi immiscibili fra loro vengono miscelati energicamente, si frantumano in piccole goccioline con un aumento della superficie dei liquidi a contatto. Questo aumento di superficie, DS, è ottenuto grazie alla forte agitazione che fornisce l'energia necessaria data dalla relazione:
(1) E = γ ΔS
l'unico parametro variabile, a parità di dispersione fra le fasi, è la tensione superficiale, γ, e questa può essere ridotta con un tensioattivo. Per questo scopo ci proponiamo di calcolare la quantità necessaria per stabilizzare un volume V di olio in acqua.
Supponiamo che i V ml di olio abbiamo una forma globulare con un raggio medio di r μm. Il volume, v, di ogni globulo - approssimativamente di simmetria sferica - è: v = 4/3 π r3
Il numero di globuli che costituiranno la fase dispersa, moltiplicato per il volume, v, di un singolo globulo, evidentemente è uguale al volume totale, V, della fase dispersa. Di conseguenza, è immediato calcolare il numero di globuli dispersi:
n = V/v = 3 V /4 π r3
Moltiplicando il numero di globuli, n, così ottenuto per la superficie di un singolo globulo (s = 4 π r2), otteniamo la superficie complessiva, S, all'interfase:
(2) S = 3 V / r
A questo punto si tratta di calcolare la quantità di tensioattivo necessaria per ottenere l'emulsione in esame. In particolare, i grammi, g, necessari utilizzando un tensioattivo di peso molecolare PM, sono dati dal numero di molecole, n·N, ciascuna di sezione trasversale, s (la piccola superficie di tensioattivo a contatto con la superficie del globulo disperso), necessarie ad avviluppare con uno strato monomolecolare la superficie complessiva, S, della fase dispersa.
(3) S = s · n · N = s · (g/PM) · N
dove:
N = numero di Avogadro;
n = numero di moli di tensioattivo
dall'equazione (3) si ottengono i grammi di tensioattivo necessari per l'emulsione:
(4) g = S · PM / s · N
inserendo la (2) nella (4) si ottiene la relazione fra grammi di tensioattivo, g, e volume, V, della fase dispersa
(5) g = 3 V · PM/( r · s · N)
sebbene la (5) si presti ad un calcolo elementare, richiede la conoscenza di due parametri approssimativi e di non immediata reperibilità: la sezione trasversale, s, di una molecola di tensioattivo; il raggio medio, r, dei globuli che costituiscono la fase dispersa. Per questa ragione il calcolo della quantità di tensioattivo viene sviluppato praticamente introducendo il concetto di HLB.
definizione di HLB
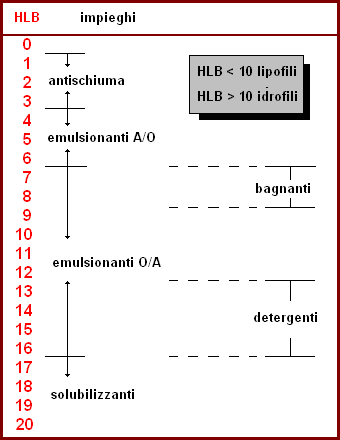 Per un impiego razionale dei tensioattivi, è di paricolare importanza determinare quantitativamente il rapporto fra le porzioni polari (idrofile) e apolari (lipofile).
Questo rapporto prende il nome di HLB (acronimo di: Hydrophylic-Lipophylic-Balance) ed è stato definito nel 1950 da William C. Griffin, come il rapporto tra il peso molecolare della parte idrofila e quello tutta la molecola del tensioattivo, diviso per 5:
Per un impiego razionale dei tensioattivi, è di paricolare importanza determinare quantitativamente il rapporto fra le porzioni polari (idrofile) e apolari (lipofile).
Questo rapporto prende il nome di HLB (acronimo di: Hydrophylic-Lipophylic-Balance) ed è stato definito nel 1950 da William C. Griffin, come il rapporto tra il peso molecolare della parte idrofila e quello tutta la molecola del tensioattivo, diviso per 5:
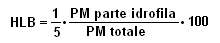
ad un ipotetico tensioattivo esclusivamente idrofilo (100%), viene attribuito un HLB = (1/5 x 100) = 20
ad un ipotetico tensioattivo esclusivamente lipofilo (100%), viene attribuito un HLB = (1/5 x 0)/100 = 0
Questo significa che l'intervallo di definizione della scala HLB (v. schema a destra) è compreso fra 0 e 20.
 Per il calcolo dell'HLB sono state proposte anche altre formule che, specialmente nel caso di tensioattivi ionici, non sempre si accordano con i dati ricavati sperimentalmente. Ad esempio, il sodio lauril sofato, a causa della sua ionizzazione, mostra un valore di HLB pari a circa 40. Dunque, l'ampiezza della scala HLB, sebbene abbia valore teorico, non è adeguata alle misure sperimentali
Per il calcolo dell'HLB sono state proposte anche altre formule che, specialmente nel caso di tensioattivi ionici, non sempre si accordano con i dati ricavati sperimentalmente. Ad esempio, il sodio lauril sofato, a causa della sua ionizzazione, mostra un valore di HLB pari a circa 40. Dunque, l'ampiezza della scala HLB, sebbene abbia valore teorico, non è adeguata alle misure sperimentali
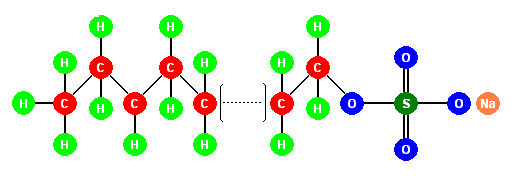
struttura del laurisolfato di sodio, un detergente. In soluzione, il sodio si stacca lasciando un gruppo solforico carico negativamente. |
Nella discussione relativa alla preparazione delle emulsioni, esamineremo le applicazioni dell'HLB
classificazione dei tensioattivi
tensioattivi anionici: presentano cariche negative ed i loro limiti d'impiego risiedono nella sensibilità alle cariche di segno opposto (che possono favorire la precipitazione), ed al pH (per quanto riguarda la dissociazione).
- saponi: sono formati da acidi grassi saturi e insaturi con catena da 12 a 18 atomi di C; la funzione carbossilica è salificata con Na, K, Mg, Pb, Al, sali ammonici, ecc. Fra i saponi, abbiamo:
- saponi alcalini: in genere stearato e palmitato di potassio; sono sostanze alcaline, irritanti e costituiscono i saponi comuni che non fanno schiuma in acque dure;
- saponi metallici di Pb e Ca;
- saponi amminici: formati da ammine di tipo amminometil-propandiolo (AMP), a contatto con acidi ricostituiscono la base e diventano realmente neutri. L'avverbio "realmente" è qui necessario in quanto la legge, con la denominazione "sapone neutro" ammette anche i saponi sodici purché esenti da alcali liberi. Questa estensione non è corretta in quanto l'alcalinità non è dovuta solo agli alcali liberi, ma anche all'idrolisi; quindi i saponi di sodio senza alcali liberi non sono realmente saponi neutri, bensì saponi con alcalinità minore.
- esteri solfonici e solfati: sono caratterizzati dall'avere un nucleo solforico o solfonico legato alla catena alifatica. Il più noto fra questi esteri, è il laurilsolfato-sodico o sodio-dodecilsolfato (SDS). Questi saponi solfonici non risentono come gli altri del pH e della durezza delle acque (vanno bene anche con acqua di mare) in quanto tanto l'acido che la base da cui sono formati, sono forti.
- solfonati: sono alcani o alchil-aril solfonati; nel secondo caso, la catena alchilica (3 o 7 atomi di carbonio) legata all'anello permette di equilibrare le caratteristiche altrimenti scarsamente lipofile dell'anello aromatico.
tensioattivi cationici: presentano cariche positive ed hanno limiti analoghi ai tensioattivi anionici.
- sali ammonici quaternari: sono i più importanti in quanto la loro attività come tensioattivi produce anche un'azione disinfettante. Sembra infatti che queste sostanze, fissandosi all'interfase tra la superficie della cellula batterica ed il liquido extracellulare, modifichino la permeabilità della membrana producendo una lisi parziale, con conseguente liberazione di materiale endocellulare.
- benzalconio cloruro: è usato, in soluzione allo 0.1%, come disinfettante; la lunghezza media della catena è 14 atomi di C.
- cetiltrimetilammonio cloruro: noto anche come cetrimide; la lunghezza media della sua catena è 16 atomi di C.
- cloruro di cetil-piridinio: noto con il nome registrato CEPACOL
- benzetonio cloruro: ha struttura complessa
tensioattivi non ionici: sono ottenuti accoppiando la parte apolare ad una funzione non ionizzabile ma con caratteristiche polari.
- eteri: contengono una catena poliossietilenica direttamente legata alla catena apolare, oppure con interposto un nucleo aromatico.
- esteri: contengono una catena poliossietilenica ma con una funzione carbossilica invece che alcolica; citiamo, per es., il glicerilmonostearato, più propriamente un poliolio. Altri polioli sono gli exitani, nei quali il tensioattivo si forma esterificando gli ossidrili con acidi grassi. I più noti tensioattivi di questo tipo sono gli SPAN (sorbitan-mono-oleato, sorbitan-mono-stearato, sorbitan-mono-palmitato, sorbitan-di-oleato, ecc.; quelli con due catene sono più idrofili): contraddistinti da numeri; ad es. SPAN 20, 40, 60, 80 ai quali corrisponde una o due catene di acido grasso ed il tipo di acido grasso. Sempre tra i tensioattivi con legame estere, troviamo composti in cui la parte idrofila è costituita da uno zucchero esterificato con un acido grasso; si ottengono così tensioattivi con sapore meno sgradevole e adatti per alimenti e preparazioni faramaceutiche orali.
| NOME |
DENOMINAZIONE CHIMICA |
HLB |
| Span 85 |
sorbitan trioleato |
1,8 |
| Span 65 |
sorbitan tristearato |
2,1 |
| Span 30 |
sorbitan sesquioleato |
3,7 |
| Span 80 |
sorbitan monooleato |
4,3 |
| Span 60 |
sorbitan monostearato |
4,7 |
| Span 40 |
sorbitan monopalmitato |
6,7 |
| Span 20 |
sorbitan monolaurato |
8,6 |
| Tween 65 |
poliossietilen sorbitan tristearato |
10,5 |
| Tween 85 |
poliossietilen sorbitan trioleato |
11,0 |
| Tween 21 |
poliossietilen sorbitan monolaurato |
13,85 |
| Tween 60 |
poliossietilen sorbitan monostearato |
14,9 |
| Tween 80 |
poliossietilen sorbitan monooleato |
15,0 |
| Tween 40 |
poliossietilen sorbitan monopalmitato |
15,6 |
| Tween 20 |
poliossietilen sorbitan monolaurato |
16,7 |
- eteri-esteri: sono composti simili agli SPAN, dove gli ossidrili non impegnati vengono condensati con ossido di etilene, formando quindi un legame etere oltre a quello estere tipico degli SPAN. Queste sostanze note come polisorbati (il nome deriva dalla contrazione del nome chimico: poliossi-etilen-sorbitan-mono-stearato), prendono il nome di TWEEN, e sono gli unici a poter essere usati per preparazioni iniettive in quanto non pirogeni, non emolitici, non irritanti. Anche per i TWEEN vale la distinzione in base ai numeri 20, 40, 60, 80, ma in più, troviamo anche numeri intermedi quali 21, 43, ecc., per indicare la presenza o meno di una seconda catena di ac. grasso apolare ed un numero "n" relativo alla/e catene poliossietileniche. Un altro tipo di tensioattivi è rappresentato da copolimeri tra poliossietilene e poliossipropilene:
PEG-PPG-PEG = Pluronics
PPG-PEG-PPG = Poloxaleni
questi tensioattivi (PEG = polietilenglicoli, PPG = polipropilenglicoli) hanno notevole affinità per la fase acquosa e vengono utilizzati per scopi particolari, ad es., per ottenere detersivi a "schiuma frenata" per lavatrici.
tensioattivi anfolitici: sono costituiti da una molecola di glicerina di cui due ossidrili sono esterificati con acidi grassi, ed il terzo ossidrile è impegnato con acido fosforico legato a colina. Queste sostanze hanno elevata concentrazione critica micellare in quanto hanno struttura ramificata e sono notevolmente solubili in acqua.
lecitine (E322): sono molecole organiche presenti nei tessuti animali e vegetali. Le lecitine sono prevalentemente concentrate nel tessuto nervoso e nei globuli rossi; sono presenti anche nel tuorlo d'uovo e nei vegetali. Sono classificate come fosfolipidi esterificati dal glicerolo ed altre molecole organiche. Le lecitine si presentano bianche, con consistenza simile a quella delle cere, sono igroscopiche e solubili in alcol, etere e nei grassi, per cui sono usate come agenti emulsionanti (cfr. tabella seguente). La lecitina per uso commerciale si ricava principalmente dalla soia.
La tabella seguente riporta le lecitine prodotte dalla ALC (American Lecithin Company)
| PRODOTTO |
HLB |
caratteristiche |
utilizzi |
| ALCOLEC XTRA-A |
2,0 |
lecitina di soia con maggior percentuale di fosfolipidi |
Kosher (approvata) |
| ALCOLEC S |
4,0 |
lecitina di soia naturale |
per uso industriale e alimentare |
| ALCOLEC BS |
4,0 |
lecitina di soia naturale |
per uso industriale e alimentare |
| ALCOLEC 439-C |
5,6 |
lecitina di soia modificata |
per pitture, rivestimenti e applicazioni tessili |
| ALCOLEC granuli |
8,0 |
lecitina di soia |
per alimenti |
| ALCOLEC F-100 polvere |
8,0 |
alto contenuto di fosfolipidi |
per alimenti |
| ALCOLEC FF-100 polvere fine |
8,0 |
lecitina polverizzata |
per alimenti |
| ALCOLEC Z-3 |
9,7 |
lecitina idrossilata (fluida) |
per alimenti |
una pubblicità diseducativa
In televisione passano occasionalmente pubblicità che mostrano modelle immerse in una vasca da bagno, oppure sotto la doccia, mentre si compiacciono a produrre sulla loro pelle una schiuma ricca e cremosa. E' logico che la schiuma debba essere cremosa, non si può certo mostrare la schiuma a bolle voluminose tipica dei canali inquinati (determinata da sostanze disperse nell'ambiente e non impiegate appositamente, come dimostra l'equazione di Gibbs). Infatti, le bolle di maggiori dimensioni si ottengono con un'alta tensione superficiale (v. equazione di Laplace), però si rompono prima e sono meno numerose.
Infatti, le bolle di maggiori dimensioni si ottengono con un'alta tensione superficiale (v. equazione di Laplace), però si rompono prima e sono meno numerose.
Il punto è che in questo caso, la pubblicità fa leva sulla specifica ignoranza del consumatore circa l'aggressività dei detergenti. Infatti, non esiste sapone o non sapone che unisca all'azione detergente un effetto idratante o rassodante. Una schiuma ricca e cremosa, al di là di un piacevole effetto, con il suo contatto prolungato sulla pelle può offrire solo svantaggi.
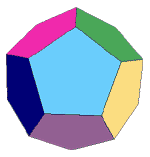 Le schiume sono costituite da un insieme compatto di bolle; tuttavia, mentre una bolla isolata assume una forma sferica in quanto consente la minima energia superficiale, le bolle ammassate tendono a disporsi in aggregati a simmetria dodecaedrica (un dodecaedro è formato da 12 facce pentagonali regolari - v. fig. a sinistra). Questi aggregati, idealmente tendono a disporsi in modo che le facce pentagonali siano messe in comune con le bolle adiacenti. Le bolle che si raccolgono in poligoni dodecaedrici, hanno approssimativamente le stesse dimensioni; la presenza di un tensioattivo di caratteristiche e concentrazione opportune, è necessaria per garantire la stabilità del letto schiumoso.
Le schiume sono costituite da un insieme compatto di bolle; tuttavia, mentre una bolla isolata assume una forma sferica in quanto consente la minima energia superficiale, le bolle ammassate tendono a disporsi in aggregati a simmetria dodecaedrica (un dodecaedro è formato da 12 facce pentagonali regolari - v. fig. a sinistra). Questi aggregati, idealmente tendono a disporsi in modo che le facce pentagonali siano messe in comune con le bolle adiacenti. Le bolle che si raccolgono in poligoni dodecaedrici, hanno approssimativamente le stesse dimensioni; la presenza di un tensioattivo di caratteristiche e concentrazione opportune, è necessaria per garantire la stabilità del letto schiumoso.
impiego dei tensioattivi nel restauro
(riadattato e riassunto da: L'uso di tensioattivi e chelanti nella pulitura di opere policrome - Collana "i Talenti", (edizioni il Prato).)
Un modo per inquadrare la versatilità dei tensioattivi, riguarda la loro applicazione nel restauro. Il loro utilizzo, trova ragione per il fatto che impartiscono particolari proprietà (le cosiddette proprietà superficiali) alle soluzioni acquose, o ai solventi organici a cui sono aggiunti, oppure per il loro potere detergente ed emulsionante.

particolare del restauro di un affresco |
Ricordiamo brevemente il loro meccanismo d'azione e le conseguenti possibili applicazioni.
A bassa concentrazione i tensioattivi in soluzione abbassano la tensione superficiale del liquido, e mostrano solo le proprietà superficiali: maggior potere bagnante, minore diffusione verticale sotto la superficie, o minore risalita capillare.
A concentrazione maggiore, in soluzione si formano aggregati di molecole di tensioattivo, detti micelle, che impartiscono alla soluzione proprietà emulsionanti, detergenti e solubilizzanti.
La quantità di tensioattivo necessaria perché si verifichi questa situazione viene detta concentrazione micellare critica (CMC), ed é caratteristica per ogni tensioattivo.
Di séguito riassumiamo le varie possibilità:
1. Uso dei tensioattivi per le proprietà superficiali.
L'acqua è il liquido a più alta tensione superficiale, seguìta dai solventi dipolari aprotici e dall'alcol benzilico. Come abbiamo discusso, un tensioattivo è una sostanza capace di abbassare la tensione superficiale del liquido al quale viene aggiunto; la conseguenza di questo abbassamento influisce sul modo in cui un liquido "bagna" una superficie, per questo i tensioattivi sono noti anche come "agenti bagnanti".
Se si vogliono variare solo queste proprietà superficiali il tensioattivo deve essere usato in piccola quantità, al di sotto della sua CMC: sono dunque sconsigliabili i tensioattivi non ionici, perché hanno una bassa CMC; invece, sono più indicati i tensioattivi anionici, come i saponi (o la Bile), si deve però tener presente che i tensioattivi anionici non sono compatibili con soluzioni a pH acido.
2. Uso dei tensioattivi per le proprietà detergenti.
In questo caso, l'attività detergente è condizionata dal raggiungimento della CMC; a questo scopo, occorre conoscere quanto tensioattivo si deve aggiungere ad una certa quantità di acqua.
Questo dato, richiede due parametri del tensioattivo: la sua CMC ed il suo Peso Molecolare (PM): entrambi possono essere ricavati dalla letteratura tecnica o dai cataloghi.
3. Uso dei tensioattivi per le proprietà emulsionanti.
Il terzo modo di utilizzo dei tensioattivi permette di miscelare tra loro liquidi altrimenti immiscibili, come acqua e solventi apolari. Anche in questo caso l'azione é una conseguenza della formazione di micelle: si deve dunque essere sicuri di usarne una quantità almeno uguale alla CMC; per questo é conveniente utilizzare tensioattivi non ionici, perché si possono impiegare in quantità minore.
Scegliendo i tensioattivi, si possono preparare emulsioni magre (O/A), o grasse (A/O). Per entrambe è possibile variare il volume della fase interna (dispersa) a seconda delle proprietà che si vogliono dall'emulsione: a "bassa fase interna", l'emulsione sarà fluida, sostanzialmente con le caratteristiche della fase disperdente (un'emulsione con poco "olio" in acqua avrà sostanzialmente le caratteristiche di una fase acquosa), mentre a maggiore concentrazione si potranno ottenere emulsioni sempre più viscose, fino ad ottenere paste dense, che scorrono con difficoltà. Questi due tipi di emulsioni, hanno impieghi differenti:
- emulsioni magre: particolarmente quelle a "bassa fase interna" possono essere usate nella pulitura. Poco solvente organico (immiscibile con acqua, come ad esempio esteri o idrocarburi) emulsionato in acqua fornisce un'emulsione che ha sostanzialmente le proprietà applicative dell'acqua pura (viscosità, ecc.) ma potere solvente modificato.
In pratica, la soluzione acquosa acquisisce un pò di potere solvente di tipo lipofilo, che può aiutare nella solubilizzazione e rimozione di un certo tipo di materiale lipofilo. Quindi senza cambiare sostanzialmente il veicolo, che resta un veicolo acquoso e si comporta a tutti gli effetti principalmente come tale (con la sua tipica atossicità), lo modifichiamo leggermente dandogli la capacità di agire su materiali altrimenti insolubili in mezzo acquoso.
Inoltre, la consistenza cremosa determina caratteristiche applicative completamente diverse da quelle del solo mezzo acquoso.
- emulsioni grasse: sono particolarmente importanti per il fatto che contengono solo una piccola quantità di acqua dispersa in un solvente lipofilo. La loro applicazione risulta molto efficace tutte le volte che occorre solubilizzare un materiale idrosolubile depositato su una superficie che però è sensibile all'acqua (esempio tipico, una doratura a foglia).
Quest'operazione può spesso essere risolta con alcuni "stratagemmi": il ricorso a soluzioni ad altissima viscosità, che controllino la diffusione del mezzo acquoso sotto la superficie, oppure a emulsioni grasse. In questo secondo modo, infatti, la piccola quantità di acqua presente nell'emulsione è sufficiente a solubilizzare il materiale idrofilo, ma il supporto sensibile all'acqua "vede" principalmente la fase disperdente, cioè un liquido apolare che non lo disturba.
Se non si dispone di apparecchiatura meccanica adeguata, come certi tipi di emulsionatori, la preparazione utilizzando solo tensioattivi liposolubili, a basso HLB, può risultare molto difficoltosa. E' sempre più semplice ed efficace utilizzare miscele in parti uguali di due tensioattivi: uno liposolubile (ad es. Span 85, HLB = 1.8) ed uno idrosolubile (ad es. Tween 20, HLB = 16.7): la miscela dei due fornisce un HLB adatto per ottenere un'emulsione grassa, ed il fatto di averlo ottenuto con due tensioattivi comporta l'ottenimento di un film emulsionante più compatto.
Anche in questo caso possiamo realizzare emulsioni a "bassa fase interna", fluide, oppure ad "alta fase interna", cremose e dense.
Nel primo caso, piccole quantità di acqua o di soluzioni acquose (ad es. ammonio idrossido diluito, acido acetico diluito, ecc.) possono essere solubilizzate in solventi organici in cui sarebbero altrimenti immiscibili (ad es. n-butilacetato, etilacetato, idrocarburi) per agire con ambiente acido o alcalino e limitare l'apporto di acqua. Questo procedimento può essere utilizzato anche per preparare miscele di alcol etilico con solventi idrocarburici (quali essenza di trementina, white spirits, e simili) che possono non essere stabili perché l'eventuale acqua presente nell'alcol (soprattutto quello con titolo basso, intorno al 90%) fa separare i due liquidi.
 1 1 |
 2 2 |
 3 3 |
4 |
 5 5 |
 6 6 |
 7 7 |
 8 8 |
 9 9 |
 HOME PAGE HOME PAGE |
Marcello Guidotti, copyright 2003-2007
questa pagina può essere riprodotta su qualsiasi supporto o rivista purché sia citata la fonte e l'indirizzo di questo sito (ai sensi degli artt. 2575 e 2576 cc. Legislazione sul diritto d'autore). Le fotografie sono tratte da siti web e sono, o possono ritenersi, di pubblico dominio purché utilizzate senza fini di lucro. Le immagini di prodotti presenti nel sito hanno unicamente valenza esemplificativa oltre che, eventualmente, illustrare messaggi fuorvianti e non vi è alcun richiamo diretto o indiretto alla loro qualità e/o efficacia il cui controllo è affidato alle autorità regolamentatorie.


 Per il calcolo dell'HLB sono state proposte anche altre formule che, specialmente nel caso di tensioattivi ionici, non sempre si accordano con i dati ricavati sperimentalmente. Ad esempio, il sodio lauril sofato, a causa della sua ionizzazione, mostra un valore di HLB pari a circa 40. Dunque, l'ampiezza della scala HLB, sebbene abbia valore teorico, non è adeguata alle misure sperimentali
Per il calcolo dell'HLB sono state proposte anche altre formule che, specialmente nel caso di tensioattivi ionici, non sempre si accordano con i dati ricavati sperimentalmente. Ad esempio, il sodio lauril sofato, a causa della sua ionizzazione, mostra un valore di HLB pari a circa 40. Dunque, l'ampiezza della scala HLB, sebbene abbia valore teorico, non è adeguata alle misure sperimentali

 Infatti, le bolle di maggiori dimensioni si ottengono con un'alta tensione superficiale (v. equazione di Laplace), però si rompono prima e sono meno numerose.
Infatti, le bolle di maggiori dimensioni si ottengono con un'alta tensione superficiale (v. equazione di Laplace), però si rompono prima e sono meno numerose.  Le schiume sono costituite da un insieme compatto di bolle; tuttavia, mentre una bolla isolata assume una forma sferica in quanto consente la minima energia superficiale, le bolle ammassate tendono a disporsi in aggregati a simmetria dodecaedrica (un dodecaedro è formato da 12 facce pentagonali regolari - v. fig. a sinistra). Questi aggregati, idealmente tendono a disporsi in modo che le facce pentagonali siano messe in comune con le bolle adiacenti. Le bolle che si raccolgono in poligoni dodecaedrici, hanno approssimativamente le stesse dimensioni; la presenza di un tensioattivo di caratteristiche e concentrazione opportune, è necessaria per garantire la stabilità del letto schiumoso.
Le schiume sono costituite da un insieme compatto di bolle; tuttavia, mentre una bolla isolata assume una forma sferica in quanto consente la minima energia superficiale, le bolle ammassate tendono a disporsi in aggregati a simmetria dodecaedrica (un dodecaedro è formato da 12 facce pentagonali regolari - v. fig. a sinistra). Questi aggregati, idealmente tendono a disporsi in modo che le facce pentagonali siano messe in comune con le bolle adiacenti. Le bolle che si raccolgono in poligoni dodecaedrici, hanno approssimativamente le stesse dimensioni; la presenza di un tensioattivo di caratteristiche e concentrazione opportune, è necessaria per garantire la stabilità del letto schiumoso.
