
 |
 La foto mostra come una lametta da barba deposta cautamente sulla superficie dell'acqua contenuta in un becker, rimanga a galla. |
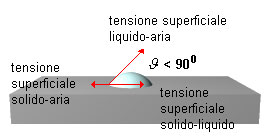
Per trattare quantitativamente il fenomeno della bagnabilità, consideriamo una goccia di liquido depositata su una superficie solida (questo procedimento permette di ottenere, con maggior semplicità, lo stesso risultato ricavabile studiando il comportamento di una superficie solida su un liquido).
Dopo aver riunito nel punto di contatto delle tre fasi aria-liqudo-solido i vettori caratterizzanti le forze superficiali (che sono tangenti alle rispettive superfici), li proiettiamo parallelamente alla superficie del solido in modo da poter formulare la condizione di equilibrio:
dove:
γ sa = tensione interfacciale solido-aria;
γ la cos θ = tensione interfacciale liquido-aria (proiettata sul piano del solido). Si noti che la componente verticale di θ la (puntata verso l'alto) è neutralizzata dalla forze di adesione fra solido e liquido.
γ sl = tensione interfacciale solido-liquido
dalla condizione di equilibrio, si ricava la relazione di Young:
| (eq. 1) |
questo significa che quando una goccia di liquido è posta su una superficie solida, il suo perimetro si sposta, allargandosi o contraendosi, fino a quando l'angolo θ assume il valore dato dalla eq. 1
In particolare, se conveniamo di correlare la bagnabilità con la misura dell'angolo θ , possono esaminare facilmente i quattro casi limite possibili:
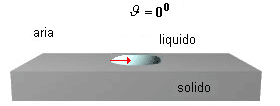 la bagnabilità è massima quando θ = 0 (cos θ = 1); è dovuta ad un bassa tensione superficiale del liquido, ad una bassa tensione interfacciale e ad una grande tensione superficiale del solido. E' quello che si verifica, per es., quando l'olio si spande sul vetro.
la bagnabilità è massima quando θ = 0 (cos θ = 1); è dovuta ad un bassa tensione superficiale del liquido, ad una bassa tensione interfacciale e ad una grande tensione superficiale del solido. E' quello che si verifica, per es., quando l'olio si spande sul vetro.
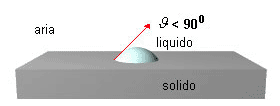 la bagnabilità è parziale quando θ < 90o (cos θ < 1).
la bagnabilità è parziale quando θ < 90o (cos θ < 1).
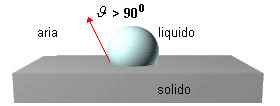 la bagnabilità è scarsa quando θ > 90o (cos θ < -1);
la bagnabilità è scarsa quando θ > 90o (cos θ < -1);
L'equazione di Young contiene quattro variabile, delle quali solo l'angolo di contatto e la tensione superficiale del liquido possono essere determinate senza troppe difficoltà. Una terza variabile, la tensione superficiale del solido, può essere determinata non sempre e comunque in condizioni piuttosto severe (v. diagramma di Zisman); la quarta variabile, la tensione interfacciale liquido-solido, è legata alla conoscenza delle precedenti tre variabili. In definitiva, l'equazione di Young ha essenzialmente valore didattico.
Per dare concretezza a quanto discusso, possiamo prendere un esempio biologico, osservando che l'angolo di contatto tra l'acqua e lo strato ceroso che riveste le foglie è ottuso, a dimostrazione di una bassa bagnabilità che impedisce la deposizione sulla foglia di uno strato continuo di rugiada in grado di ostruirne i pori.
Nel campo della tecnica farmaceutica, il problema della bagnabilità si presenta per le soluzioni iniettabili e sospensioni acquose, nelle quali il solido deve disperdersi molto bene; Così, molte polveri debolmente idrofile (cfr. tab. accanto) come l'acido stearico, o fortemente idrofobiche come il magnesio stearato o il fenilbutazone, rendono necessario l'uso di tensioattivi per impedirne il galleggiamento. Anche la differente struttura cristallina (cfr. tab.) può influenzare la bagnabilità, come nel caso delle due forme di cloramfenicolo palmitato.
Si deve ricordare che la bagnabilità di un principio attivo influenza influenza notevolmente la sua tendenza a disperdersi nell'ambiente gastrointestinale e quindi a passare nella soluzione dalla quale sarà successivamente assorbito.
| sostanza | angolo | sostanza | angolo | sostanza | angolo |
| ac. acetilsal. | 74 | cloramfenicolo palmitato (forma beta) | 108 | fenacetina | 78 |
| aminofillina | 47 | diazepam | 83 | prednisolone | 43 |
| aminofillina (anidra) | 35 | digossina | 49 | salicilamide | 70 |
| ampicillina triidrata | 21 | lattosio | 30 | ac. salicilico | 103 |
| barbital | 70 | magnasio stearato | 121 | ac. stearico | 98 |
| ac. borico | 74 | nitrofurantoina | 69 | teofillina | 60 |
| cloramfenicolo palmitato (forma alfa) | 122 | pentobarbital | 86 | aJ. Pharm Sci. | |
La bagnabilità è una caratteristica estremamente importante nelle lenti a contatto, in quanto il mantenimento del film lacrimale precorneale, nella forma di un sottile strato capillare, è una necessità fondamentale per la compatibilità fisiologica tra paziente e lente. L'acqua ha una tensione superficiale più grande della maggior parte dei liquidi, a causa del legame idrogeno che si instaura tra le sue molecole. Ad esempio, il film lacrimale ha una tensione superficiale (46 dine/cm) minore di quella dell'acqua pura (72,8 dine/cm ).
La soluzione proposta da Zisman, prevede la determinazione della tensione superficiale del solido ricorrendo ad un artificio. Si prendono alcuni liquidi con caratteristiche chimiche simili (questa è una difficoltà non marginale) e se ne misura l'angolo di contatto con il solido del quale si vuole determinare la tensione superficiale.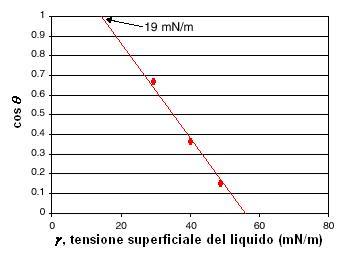 Riportando su un grafico (v. diagramma a sinistra) l'angolo di contatto (in ordinate) contro la tensione superficiale del liquido (in ascisse), si è visto sperimentalmente che si ottiene approssimativamente una retta. Di qui è nata l'idea di estrapolare la retta fino ad incontrare il valore per cui l'angolo di contatto è zero.
Riportando su un grafico (v. diagramma a sinistra) l'angolo di contatto (in ordinate) contro la tensione superficiale del liquido (in ascisse), si è visto sperimentalmente che si ottiene approssimativamente una retta. Di qui è nata l'idea di estrapolare la retta fino ad incontrare il valore per cui l'angolo di contatto è zero.
In effetti, nessun liquido raggiunge realmente il valore zero per l'angolo di contatto; se ciò accadesse, il liquido si distenderebbe sulla superficie del solido formando un film monomolecolare ancora in grado di mantenere una propria coesione e non frammentarsi. In questo caso, la tensione superficiale del liquido risulterebbe pressocché coincidente con quella del solido.
L'ipotesi predetta può essere dimostrata fisicamente. A questo scopo, consideriamo due sostanze differenti unite tra loro da forze di adesione. L'energia necessaria per separarle è data dalla differenza fra l'energia superficiale delle superfici separate e le due superfici ( di area A) unite dalle forze di adesione:
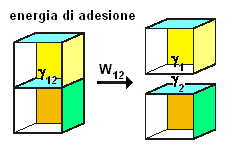 1) W(ades) = γ1 A + γ2 A - γ12 A
1) W(ades) = γ1 A + γ2 A - γ12 A
dividendo ambo i membri per A, otteniamo l'energia superficiale unitaria:
2) w(a) = γ1 + γ2 - γ12
Ora, consideriamo un'unica sostanza la cui struttura unitaria è garantita unicamente da forze di coesione. In questo caso, l'energia necessaria per separare due superfici è data dalla differenza fra l'energia superficiale delle superfici separate e quella delle due superfici unite da forze di coesione (in questo caso l'energia superficiale del sistema in toto è nulla, come per qualsiasi sistema di riferimento) :
 3) W(coes) = γ1 A + γ1 A - 0 = 2 γ1
3) W(coes) = γ1 A + γ1 A - 0 = 2 γ1
dividendo ambo i membri per A, otteniamo l'energia superficiale unitaria:
4) w(c) = 2 γ1
Consideriamo nuovamente l'equazione di Young:
5) γl cos θ + γsl - γs = 0
la tensione superficiale dovuta alle forze di adesione che si manifestano tra un solido ed un liquido (in base alla 2), è:
6) w(a) = γs + γl - γsl
combinandola con l'equazione di Young (eguagliando γs - γsl), si ottiene:
7) w(a) = γl + γl cos θ
ora, quando cos θ = 1, risulta: w(a) = 2 γl
e poiché l'energia superficiale di coesione per un solido è w(c) = 2 γs, risulta che w(a) = w(c)
La sabbia comune è a flusso libero (cioé non ha coesione) e quindi non può formare una struttura in grado di mantenere la forma desiderata. Al contrario la sabbia magica - grazie alle sue proprietà idrofobiche - quando è immersa in acqua, mantiene la propria struttura che può persino essere modellata sotto acqua conferendo forme astratte o addirittura realizzando castelli di sabbia... nell'acqua!
 Questa sabbia offre interessanti spunti didattici in quanto permette di comprendere le proprietà delle molecole d'acqua e come funzionano i prodotti idrorepellenti: confrontando la sabbia magica con la sabbia normale è facile comprendere le proprietà idrorepellenti che conferiscono le differenze di comportamento nei confronti dell'acqua.
Questa sabbia offre interessanti spunti didattici in quanto permette di comprendere le proprietà delle molecole d'acqua e come funzionano i prodotti idrorepellenti: confrontando la sabbia magica con la sabbia normale è facile comprendere le proprietà idrorepellenti che conferiscono le differenze di comportamento nei confronti dell'acqua.
La sabbia magica fu progettata per intrappolare gli olii fuoriusciti in prossimita delle spiagge. La sabbia idrorepellente, versata sul petrolio galleggiante, avrebbe formato un miscuglio che - essendo più denso dell'acqua - sarebbe affondato insieme all'olio intrappolato. D'altra parte, per una serie di problemi fra cui gli elevati costi di produzione, questo progetto non è stato mai utilizzato, preferendovi altri sistemi (v. bonifica di sostanze bituminose).
Le proprietà descritte sono ottenute rivestendo comune sabbia con vapori di dimetil-dicloro-silano [(CH3)2SiCl2] , un componente siliconico che si lega alla polvere di silice. Con questo processo i granelli di sabbia sono avviluppati da un rivestimento idrofobo [(CH3)2(OH)Si-O-] che impedisce, appunto, la dispersione della sabbia in acqua.
| 4 | ||||||||
Marcello Guidotti, copyright 2003, 2005, 2007, 2013
questa pagina può essere riprodotta su qualsiasi supporto o rivista purché sia citata la fonte e l'indirizzo di questo sito (ai sensi degli artt. 2575 e 2576 cc. Legislazione sul diritto d'autore). Le fotografie sono tratte da siti web e sono, o possono ritenersi, di pubblico dominio purché utilizzate senza fini di lucro. Le immagini di prodotti presenti nel sito hanno unicamente valenza esemplificativa oltre che, eventualmente, illustrare messaggi fuorvianti e non vi è alcun richiamo diretto o indiretto alla loro qualità e/o efficacia il cui controllo è affidato alle autorità regolamentatorie.