equazione di Laplace
Una bolla è una superficie sferica di liquido. La tensione superficiale e la pressione esterna, pe tendono a ridurre questa superficie, ma ciò è contrastato dalla pressione, pi, all'interno della bolla.
In pratica, si deve avere: pe + p (dovuta alla tensione sup.) = pi
Ci proponiamo di calcolare il valore della pressione dovuta alle forze di tensione superficiale.
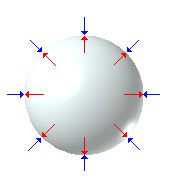
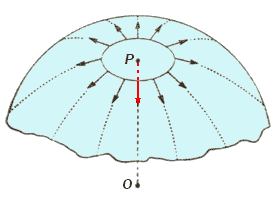 Abbiamo visto che le forze di tensione superficiale, sono tangenti alla superficie in seno alla quale si sviluppano; d'altra parte, l'origine di queste forze è da ricercare nella differente attrazione tra le molecole che si trovano alla superficie di separazione tra due fasi (cfr. fenomeni superficiali). Così, se consideriamo una bolla sferica, possiamo comprendere che le forze attrattive dirette verso il centro (come la forza lungo il raggio OP, in figura) si annullano reciprocamente per simmetria e dunque sono solo le forze di tensione superficiale tangenti alla sua superficie che agiscono sulla superficie della bolla.
Abbiamo visto che le forze di tensione superficiale, sono tangenti alla superficie in seno alla quale si sviluppano; d'altra parte, l'origine di queste forze è da ricercare nella differente attrazione tra le molecole che si trovano alla superficie di separazione tra due fasi (cfr. fenomeni superficiali). Così, se consideriamo una bolla sferica, possiamo comprendere che le forze attrattive dirette verso il centro (come la forza lungo il raggio OP, in figura) si annullano reciprocamente per simmetria e dunque sono solo le forze di tensione superficiale tangenti alla sua superficie che agiscono sulla superficie della bolla.
Ora, immaginiamo di avere un piccola bolla e di volerne aumentare il volume: se fosse un palloncino gonfiabile introdurremmo aria attraverso il suo collo; nel nostro caso, però, il processo non è diretto, bensì diffusivo e quindi attraverso tutta la membrana superficiale dovrà trasferirsi un flusso d'aria capace di produrre all'interno della bolla una pressione, pi, maggiore della pressione esterna pe. Per conseguenza, la bolla aumenterà il proprio volume richiedendo un'energia pari al lavoro di espansione a pressione costante:
E = (pi - pe)ΔV = pΔV
l'energia opposta dalle forze di tensione superficiale per contrastare l'aumento di superficie della bolla è:
E = γ ΔS
Ora, consideriamo una bolla di raggio R, evidentemente il suo volume è quello di una sfera:
(1) 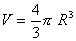
 immaginiamo che la bolla aumenti il suo volume di una quantità infinitesima; ciò si può ottenere differenziando la (1):
immaginiamo che la bolla aumenti il suo volume di una quantità infinitesima; ciò si può ottenere differenziando la (1):
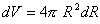
la bolla di raggio R, ha una superficie pari a:
(2) 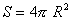
se la bolla aumenta il suo volume, deve anche aumentare la propria superficie e questa variazione si ottiene differenziando la (2):
dS = 8p R dR
l'energia richiesta dalla pressione per aumentare il volume della bolla è:
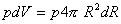
l'energia opposta dalle forze di tensione superficiale per aumentare la superficie della bolla è:
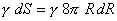
eguagliando le due energie, si ottiene la formula di Laplace:
p = 2 γ /R
questa formula viene solitamente posta nella forma:
Due punti devono essere sottolineati:
- la differenza di pressione all'interno della bolla eguaglia la pressione esterna addizionata di 2γ/R e dunque, è proporzionale alla tensione superficiale. Questo significa che, per formare una bolla all'interno di un liquido con elevata tensione superficiale, è richiesta una pressione interna maggiore;
- è più facile formare una bolla di dimensioni maggiori in quanto il termine additivo 2γ/R diminuisce con il raggio, R.
Un liquido bolle quando raggiunge la temperatura per la quale inizia a convertirsi in vapore e la sua pressione supera la pressione atmosferica in modo da vincere anche la tendenza della tensione superficiale a schiacciare la bolla. Ora, bolle più grandi si formano più facilmente in quanto le forze di tensione superficiale sono minori. Però, le bolle che si formano inizialmente sono molto piccole e dunque, essendo sottoposte ad una enorme tensione superficiale, addirittura non potrebbero formarsi. In realtà, queste bollicine si formano su particelle estranee e questo permette loro di partire con un raggio abbastanza grande da richiedere solo una modesta pressione. Questo spiega perché sia possibile riscaldare acqua molto pulita fino a oltre 100 °C senza che avvenga l'ebollizione: in questo caso, si parla di acqua surriscaldata. I liquidi surriscaldati sono instabili: se vengono agitati leggermente in modo che si formino delle bolle, tutto il liquido improvvisamente prende a bollire tumultuosamente.
Riassumendo: l'equazione di Laplace, mostra che le bolle più grandi sono ottenibili più facilmente. Inoltre, se la tensione superficiale è bassa (per esempio, per aggiunta di tensioattivi), si possono ottenere le schiume: masse soffici costituite da numerosissime bollicine.
rottura e collasso delle bolle
 Una bolla, con la presenza di un tensioattivo, si presenta come una struttura adatta a contrastare qualsiasi pressione esterna. Le molecole reggono la spinta perché vengono compresse l'una contro l'altra, come la classica struttura ad arco (fig. a destra), dove l'intera struttura si regge per mutuo contrasto, ed il punto critico, in mancanza del quale si avrebbe il suo collasso, è detto "chiave di volta"
Una bolla, con la presenza di un tensioattivo, si presenta come una struttura adatta a contrastare qualsiasi pressione esterna. Le molecole reggono la spinta perché vengono compresse l'una contro l'altra, come la classica struttura ad arco (fig. a destra), dove l'intera struttura si regge per mutuo contrasto, ed il punto critico, in mancanza del quale si avrebbe il suo collasso, è detto "chiave di volta"
Ciò premesso, immaginiamo che per qualche ragione la bolla perda momentaneamente la forma sferica assumendo per esempio la forma schiacciata della figura seguente.
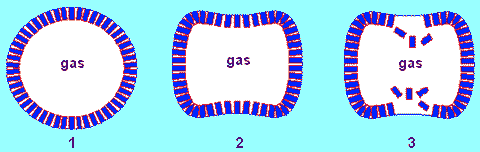
bolla con una pellicola di tensioattivo che perde la forma sferica (2) e si frantuma (3)
Si vede sùbito che in alcuni punti la pellicola di tensioattivo non si autosostiene: le sue molecole, a causa della repulsione reciproca, si staccano senza opporre resistenza dalla superficie e vengono proiettate verso l'interno (fig. 3). A questo punto le zone prive di tensioattivo tendono a riacquistare bruscamente la forma sferica innescando un processo vibratorio che scuote violentemente tutta la superficie. Questa sorta di terremoto, date le dimensioni microscopiche della bolla, mette in gioco elevatissime pressioni che provocano l'espulsione verso l'interno di tutto il tensioattivo. Il destino della bolla è allora inevitabile: la tensione superficiale, stringendola in una morsa inesorabile la comprime fino a farla collassare in una frazione di secondo. Ovviamente, si possono verificare anche altri processi catastrofici, come la rottura in bolle più piccole.
Vedremo in particolare l'importanza delle bolle discutendo i princìpi della sonicazione.
cavitazione ed ebollizione
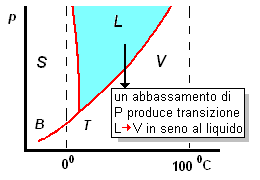 La cavitazione è un fenomeno consistente nella formazione di zone di vapore all'interno di un liquido, le quali successivamente collassano. Questo fenomeno si produce quando, in conseguenza di moti turbolenti in seno ad un liquido, vi si instaurano localmente abbassamenti della pressione : se in quelle zone la pressione è inferiore alla tensione di vapore del liquido stesso, si avrà il passaggio da liquido a vapore con formazione appunto di cavità contenenti vapore.
La cavitazione è un fenomeno consistente nella formazione di zone di vapore all'interno di un liquido, le quali successivamente collassano. Questo fenomeno si produce quando, in conseguenza di moti turbolenti in seno ad un liquido, vi si instaurano localmente abbassamenti della pressione : se in quelle zone la pressione è inferiore alla tensione di vapore del liquido stesso, si avrà il passaggio da liquido a vapore con formazione appunto di cavità contenenti vapore.
Sebbene i due fenomeni, cavitazione ed ebollizione, siano apparentemente simili, presentano una differenza sostanziale:
- nell'ebollizione la pressione di vapore aumenta fino a superare le forze di tensione superficiale, con la formazione di una bolla stabile in quanto il vapore in essa contenuto è alla stessa pressione del liquido in cui è immersa.
- la bolla di cavitazione è instabile in quanto appena la bolla lascia la zona di bassa pressione, collassa (implode violentemente) in quanto la pressione interna non è più sufficiente a contrastare la pressione esterna e le forze di tensione superficiale.
 |
|
 |
| Fig. 1 - implosione di una bolla di cavitazione ripresa con un flash ad elevata velocità. La trasparenza solo nella parte frontale è dovuta alla differente esposizione alla luce del flash. (National Center for Physical Acoustics, University of Mississippi). |
|
Fig. 2 - il collasso della bolla vicino ad una superficie estesa è asimmetrico e conduce ad una variazione di forma che si manifesta a velocità maggiore di 100m/s. (tratto da: www.scs.uiuc.edu/suslick/execsummsono.html) |
A questo punto, compreso il fenomeno, rimane da chiarire perché in seno al liquido si formano locamente zone di bassa pressione. Questo fenomeno (discusso più esaurientemente nella sonicazione) può avvenire sulle eliche delle navi, nelle pompe, nel sistema vascolare delle piante, nei processi di sonicazione: praticamente nei liquidi in movimento. In particolare, la cavitazione è favorita dalla presenza di un substrato che agisca da centro di nucleazione (per esempio, la superficie di un contenitore, impurità presenti nel liquido oppure altre irregolarità). Anche la temperatura ha una notevole influenza sulla cavitazione, poiché altera la tensione di vapore e la tensione superficiale. Se la temperatura aumenta, la tensione di vapore aumenta, la tensione superficiale diminuisce (v. eq. di Eötvös) e ciò facilita la cavitazione.
la formula di Laplace e l'embolìa
L'embolìa è un'ostruzione parziale o totale di un vaso sanguigno ad opera di un embolo solido, liquido o gassoso che produce disturbi circolatori locali o generali. L'embolia può essere venosa o arteriosa, a seconda del vaso interessato. Se l'embolo passa nel cuore e dalle vene passa alle arterie si può verificare un quadro patologico molto grave che determina un infarto polmonare o un embolo polmonare.
Generalmente l'infortunato avverte un forte dolore acuto in corrispondenza del punto del corpo dove si è manifestata l'occlusione. L'embolo di natura solida è di origine interna, per esempio, può essere costituito da frammenti di trombi, o coaguli di sangue. L'embolo liquido può verificarsi ad esempio durante un'iniezione intramuscolare di farmaci oleosi che, invece di entrare nel muscolo, finiscono in un vaso. L'embolo gassoso è tipico per esempio dei subacquei che risalgono in superficie troppo rapidamente da profondità elevate. Questa improvvisa differenza di pressione determina un vero e proprio ribollimento del sangue che libera gas disciolti, in particolare l'azoto, in modo tumultuoso (si faccia attenzione: in conseguenza di immersioni in apnea effettuate al limite delle capacità ed a brevi intervalli l'una dall'altra, sono stati riferiti casi di embolìa!).
L'embolo gassoso è tipico per esempio dei subacquei che risalgono in superficie troppo rapidamente da profondità elevate. Questa improvvisa differenza di pressione determina un vero e proprio ribollimento del sangue che libera gas disciolti, in particolare l'azoto, in modo tumultuoso (si faccia attenzione: in conseguenza di immersioni in apnea effettuate al limite delle capacità ed a brevi intervalli l'una dall'altra, sono stati riferiti casi di embolìa!).
La formula di Laplace permette di spiegare perché una bollicina di gas (embolo) che per qualche ragione venga a trovarsi in seno al flusso ematico, anziché essere trascinata dal flusso sanguigno, possa produrre un fenomeno occlusivo, spesso fonte di gravi conseguenze.
Se la bollicina ha un diametro superiore di quello della sezione del circolo ematico in cui si forma, in condizioni di quiete, assumerebbe una geometria simile a quella schematizzata nella figura a destra.
La presenza di una bolla indica chiaramente che la pressione al suo interno è superiore a quella del fluido in cui è immersa.
Per effetto della spinta esercitata dal fluido che tenta di scorrere nel tratto occupato dalla bolla, questa assume la forma in figura: la riduzione del raggio di curvatura dell'estremo a valle (la curvatura della parte a monte è molto maggiore), fa aumentare la pressione p al suo interno. Per conseguenza, la pressione interna - v. legge di Laplace - aumenta e quindi la bolla esercita sulle pareti del tratto ostruito una pressione maggiore di quella del fluido che la circonda, provocando così un'azione frenante al suo movimento. Un embolo di grandi dimensioni, o più emboli l'uno dietro l'altro possono addirittura provocare l'arresto della circolazione ematica nel tratto interessato.
La gravità di un'embolia dipende dal tipo di vaso interessato e dalla sua ostruzione che può essere parziale o totale, producendo il cosiddetto "infarto rosso", cioè rottura del vaso con perdita di sangue. Se l'embolo interessa il cervello o il cuore è necessario intervenire tempestivamente. Anche un embolo in un arto, tuttavia, se l'ostruzione è totale, può richiedere un intervento chirurgico per rimuoverlo ed evitare la necrosi dei tessuti che non vengono più irrorati dal sangue.
una combinazione esplosiva
 Addizionando un intero pacchetto di caramelle Mentos® ad una bottiglia di coca-cola®, si ottiene un fenomeno spumeggiante...
Addizionando un intero pacchetto di caramelle Mentos® ad una bottiglia di coca-cola®, si ottiene un fenomeno spumeggiante...
La spiegazione è di natura fisica e non chimica. Ordinariamente, l'acqua resiste all'espansione delle bolle di CO2 in quanto le molecole di acqua si attraggono fortemente fra loro formando una maglia stretta intorno ad ogni bolla. Allontanare le molecole di acqua l'una dall'altra per formare una nuova bolla, o per espandere una bolla che già è stata formata, richiede energia contrastata dalla tensione superficiale.
Se si lascia cadere una Mentos nella bevanda, la gelatina e la gomma arabica della caramella si dissolvono interrompendo la struttura dell'acqua e quindi diminuendone la tensione superficiale, in modo da richiedere meno energia per espandere le bolle. Inoltre, la rugosità della superficie della caramella fornisce molti punti d'innesco e piccole fessure che permettono alle nuove bolle di formarsi più rapidamente (il processo è chiamato nucleazione).
Via via che la superficie della caramella si dissolve, entrambi i processi accelerano e la schiuma inizia velocemente a formarsi. Si può osservare un effetto simile quando si cucinano le patate o la pasta in una pentola d'acqua in ebollizione. L'acqua a volte bollirà in eccedenza perché i materiali organici liberati dalle patate o dalla pasta di cottura interrompono la stretta maglia delle molecole di acqua alla sua superficie, rendendo più facile la formazione di bolle e schiuma. Anche la root beer spuma in eccedenza se le si aggiunge una paletta di gelato, e la spiegazione è essenzialmente la stessa: la tensione superficiale della birra è abbassata dalle gomme e dalle proteine del gelato in fusione e la CO2 che sgassa dalla birra forma una schiuma.
il bicchiere sul comodino si riempie di bolle
 Azoto (77%) e ossigeno (21%) costituiscono la maggior percentuale dei gas presenti nell'atmosfera e possono solubilizzarsi nell'acqua in una quantità che dipende dalla temperatura dell'acqua e dalla pressione atmosferica all'interfaccia acqua/aria. Quanto più la temperatura è bassa e la pressione è alta, maggiore è il gas disciolto; al contrario, una temperatura maggiore e una pressione ridotta limitano la quantità di gas che può essere solubilizzato.
Azoto (77%) e ossigeno (21%) costituiscono la maggior percentuale dei gas presenti nell'atmosfera e possono solubilizzarsi nell'acqua in una quantità che dipende dalla temperatura dell'acqua e dalla pressione atmosferica all'interfaccia acqua/aria. Quanto più la temperatura è bassa e la pressione è alta, maggiore è il gas disciolto; al contrario, una temperatura maggiore e una pressione ridotta limitano la quantità di gas che può essere solubilizzato.
Quando si preleva acqua dal rubinetto riempiendo un bicchiere e lo si posa su un tavolo, l'acqua si porta a temperatura ambiente e l'ossigeno e l'azoto in essa disciolti diminuiscono la propria solubilità e lentamente risalgono verso la superficie in forma di piccole bolle. Ovviamente questa è una descrizione del fenomeno che chiama in causa la diminuzione di solubilità, però questo è l'effetto, e non spiega cosa accade... per scoprirlo, occorre riferirsi al fenomeno della cavitazione.

La cavitazione (cfr. sonicazione) è un fenomeno fisico che avviene a causa dell'abbassamento locale della pressione all'interno della massa liquida, fino a raggiungere la tensione di vapore del liquido stesso, che subisce così un cambiamento di fase a gas, formando delle bolle (cavità) contenenti vapore, che poi implodono producendo un rumore caratteristico e liberando una notevole quantità di energia.
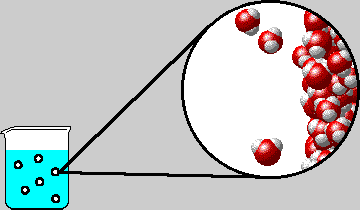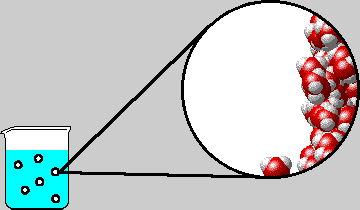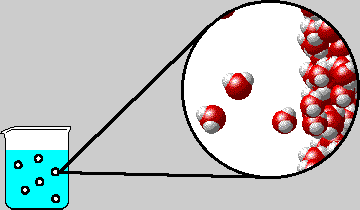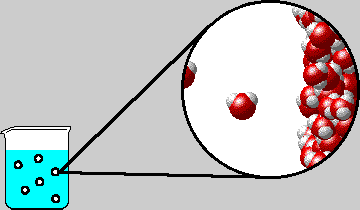 Le molecole di gas disciolte in acqua si muovono continuamente all'interno dei liquidi e seguono i vari gradienti di pressione che le portano verso zone localmente a pressione inferiore; quando si forma una bolla di cavitazione (cfr. sonicazione), le molecole di gas con maggior energia cinetica (quindi più veloci) diffondono al suo interno e raggiungono una concentrazione tale da contrastare l'inviluppo delle molecole d'acqua che le circondano (superano il valore di solubilità permesso dall'acqua o dal liquido in cui sono contenute) e si fanno strada verso la superficie avvolte da una pellicola formata appunto da molecole d'acqua. Questa pellicola si rompe appena la bolla raggiunge la superficie.
Le molecole di gas disciolte in acqua si muovono continuamente all'interno dei liquidi e seguono i vari gradienti di pressione che le portano verso zone localmente a pressione inferiore; quando si forma una bolla di cavitazione (cfr. sonicazione), le molecole di gas con maggior energia cinetica (quindi più veloci) diffondono al suo interno e raggiungono una concentrazione tale da contrastare l'inviluppo delle molecole d'acqua che le circondano (superano il valore di solubilità permesso dall'acqua o dal liquido in cui sono contenute) e si fanno strada verso la superficie avvolte da una pellicola formata appunto da molecole d'acqua. Questa pellicola si rompe appena la bolla raggiunge la superficie.
L'evaporazione è un processo che avviene all'interfaccia liquido-aria e interessa quelle molecole che animate da maggior energia cinetica, abbandonano direttamente la superficie del liquido. In particolare, la velocità di evaporazione aumenta con l'aumentare dell'interfaccia liquido-aria.
Mentre l'evaporazione interessa la superficie di un liquido, la cavitazione e l'ebollizione avvengono al suo interno; tuttavia la dinamica del processo di cavitazione differisce da quella dell'ebollizione. In quest'ultima, l'aumento di temperatura che interessa tutto il sistema aumenta la tensione di vapore del liquido e diminuisce la sua tensione superficiale creando bolle meccanicamente stabili, perché piene di vapore alla stessa pressione del liquido circostante. Al contrario, nella cavitazione è la pressione del liquido a scendere improvvisamente, mentre la temperatura, la tensione di vapore e la tensione superficiale restano costanti. Per questo motivo le "bolle" di cavitazione resistono solo finché non abbandonano la zona di bassa pressione idrostatica: appena le bolle si trovano in una zona del fluido in quiete, la pressione di vapore non è sufficiente a contrastare la pressione idrostatica ed implodono immediatamente.
 1 1 |
 2 2 |
 3 3 |
 4 4 |
5 |
 6 6 |
 7 7 |
 8 8 |
 9 9 |
 HOME PAGE HOME PAGE |
Marcello Guidotti, copyright 2003-2004-2007-2013
questa pagina può essere riprodotta su qualsiasi supporto o rivista purché sia citata la fonte e l'indirizzo di questo sito (ai sensi degli artt. 2575 e 2576 cc. Legislazione sul diritto d'autore). Le fotografie sono tratte da siti web e sono, o possono ritenersi, di pubblico dominio purché utilizzate senza fini di lucro. Le immagini di prodotti presenti nel sito hanno unicamente valenza esemplificativa oltre che, eventualmente, illustrare messaggi fuorvianti e non vi è alcun richiamo diretto o indiretto alla loro qualità e/o efficacia il cui controllo è affidato alle autorità regolamentatorie.
 Abbiamo visto che le forze di tensione superficiale, sono tangenti alla superficie in seno alla quale si sviluppano; d'altra parte, l'origine di queste forze è da ricercare nella differente attrazione tra le molecole che si trovano alla superficie di separazione tra due fasi (cfr. fenomeni superficiali). Così, se consideriamo una bolla sferica, possiamo comprendere che le forze attrattive dirette verso il centro (come la forza lungo il raggio OP, in figura) si annullano reciprocamente per simmetria e dunque sono solo le forze di tensione superficiale tangenti alla sua superficie che agiscono sulla superficie della bolla.
Abbiamo visto che le forze di tensione superficiale, sono tangenti alla superficie in seno alla quale si sviluppano; d'altra parte, l'origine di queste forze è da ricercare nella differente attrazione tra le molecole che si trovano alla superficie di separazione tra due fasi (cfr. fenomeni superficiali). Così, se consideriamo una bolla sferica, possiamo comprendere che le forze attrattive dirette verso il centro (come la forza lungo il raggio OP, in figura) si annullano reciprocamente per simmetria e dunque sono solo le forze di tensione superficiale tangenti alla sua superficie che agiscono sulla superficie della bolla.
 immaginiamo che la bolla aumenti il suo volume di una quantità infinitesima; ciò si può ottenere differenziando la (1):
immaginiamo che la bolla aumenti il suo volume di una quantità infinitesima; ciò si può ottenere differenziando la (1):
 Una bolla, con la presenza di un tensioattivo, si presenta come una struttura adatta a contrastare qualsiasi pressione esterna. Le molecole reggono la spinta perché vengono compresse l'una contro l'altra, come la classica struttura ad arco (fig. a destra), dove l'intera struttura si regge per mutuo contrasto, ed il punto critico, in mancanza del quale si avrebbe il suo collasso, è detto "chiave di volta"
Una bolla, con la presenza di un tensioattivo, si presenta come una struttura adatta a contrastare qualsiasi pressione esterna. Le molecole reggono la spinta perché vengono compresse l'una contro l'altra, come la classica struttura ad arco (fig. a destra), dove l'intera struttura si regge per mutuo contrasto, ed il punto critico, in mancanza del quale si avrebbe il suo collasso, è detto "chiave di volta"

 La cavitazione è un fenomeno consistente nella formazione di zone di vapore all'interno di un liquido, le quali successivamente collassano. Questo fenomeno si produce quando, in conseguenza di moti turbolenti in seno ad un liquido, vi si instaurano localmente abbassamenti della pressione : se in quelle zone la pressione è inferiore alla tensione di vapore del liquido stesso, si avrà il passaggio da liquido a vapore con formazione appunto di cavità contenenti vapore.
La cavitazione è un fenomeno consistente nella formazione di zone di vapore all'interno di un liquido, le quali successivamente collassano. Questo fenomeno si produce quando, in conseguenza di moti turbolenti in seno ad un liquido, vi si instaurano localmente abbassamenti della pressione : se in quelle zone la pressione è inferiore alla tensione di vapore del liquido stesso, si avrà il passaggio da liquido a vapore con formazione appunto di cavità contenenti vapore.


 L'embolo gassoso è tipico per esempio dei subacquei che risalgono in superficie troppo rapidamente da profondità elevate. Questa improvvisa differenza di pressione determina un vero e proprio ribollimento del sangue che libera gas disciolti, in particolare l'azoto, in modo tumultuoso (si faccia attenzione: in conseguenza di immersioni in apnea effettuate al limite delle capacità ed a brevi intervalli l'una dall'altra, sono stati riferiti casi di embolìa!).
L'embolo gassoso è tipico per esempio dei subacquei che risalgono in superficie troppo rapidamente da profondità elevate. Questa improvvisa differenza di pressione determina un vero e proprio ribollimento del sangue che libera gas disciolti, in particolare l'azoto, in modo tumultuoso (si faccia attenzione: in conseguenza di immersioni in apnea effettuate al limite delle capacità ed a brevi intervalli l'una dall'altra, sono stati riferiti casi di embolìa!).


 Addizionando un intero pacchetto di caramelle Mentos® ad una bottiglia di coca-cola®, si ottiene un fenomeno spumeggiante...
Addizionando un intero pacchetto di caramelle Mentos® ad una bottiglia di coca-cola®, si ottiene un fenomeno spumeggiante...
 Azoto (77%) e ossigeno (21%) costituiscono la maggior percentuale dei gas presenti nell'atmosfera e possono solubilizzarsi nell'acqua in una quantità che dipende dalla temperatura dell'acqua e dalla pressione atmosferica all'interfaccia acqua/aria. Quanto più la temperatura è bassa e la pressione è alta, maggiore è il gas disciolto; al contrario, una temperatura maggiore e una pressione ridotta limitano la quantità di gas che può essere solubilizzato.
Azoto (77%) e ossigeno (21%) costituiscono la maggior percentuale dei gas presenti nell'atmosfera e possono solubilizzarsi nell'acqua in una quantità che dipende dalla temperatura dell'acqua e dalla pressione atmosferica all'interfaccia acqua/aria. Quanto più la temperatura è bassa e la pressione è alta, maggiore è il gas disciolto; al contrario, una temperatura maggiore e una pressione ridotta limitano la quantità di gas che può essere solubilizzato.

 Le molecole di gas disciolte in acqua si muovono continuamente all'interno dei liquidi e seguono i vari
Le molecole di gas disciolte in acqua si muovono continuamente all'interno dei liquidi e seguono i vari