dove:
R = costante dei gas;
T = temperatura assoluta;
Δ c = differenza di concentrazione del soluto tra interfase e massa del liquido;
γ1 = tensione superficiale iniziale;
γ2 = tensione superficiale finale
dall'equazione di Gibbs, si deduce che sono possibili tre casi:
 Le modificazioni della membrana superficiale richiedono energia, ed è quindi logico che si presenti quella configurazione che richiede la minor quantità di energia, ossia la membrana che ha la minor tensione superficiale a parità di superficie. Pertanto, le molecole di quelle sostanze che riducono la tensione superficiale si concentreranno in superficie, mentre le molecole che la aumentano verranno respinte.
Le modificazioni della membrana superficiale richiedono energia, ed è quindi logico che si presenti quella configurazione che richiede la minor quantità di energia, ossia la membrana che ha la minor tensione superficiale a parità di superficie. Pertanto, le molecole di quelle sostanze che riducono la tensione superficiale si concentreranno in superficie, mentre le molecole che la aumentano verranno respinte.
A questo punto, sorge una questione: perché alla superficie non si addensano molecole di un solo tipo? Per esempio, nel caso della soluzione acquosa di acido acetico, perché non restano in superficie solo molecole di acido acetico? E, nel caso della soluzione acquosa di NaCl perché non restano in superficie solo molecole di acqua, in modo da rendere la tensione superficiale la più bassa possibile?
Per rispondere a queste domande, si deve tener conto che oltre all'energia legata alle modificazioni dello strato superficiale, si deve considerare l'energia necessaria per far variare la concentrazione di una sostanza, ossia l'energia necessaria per trasferire le molecole da una regione ad un'altra (lavoro osmotico). Pertanto, si formerà la membrana con una proporzione delle diverse specie di molecole tale che il bilancio fra il lavoro superficiale ed il lavoro osmotico, corrisponde a quello che richiede la minor quantità di energia.
Le sostanze che influenzano la tensione superficiale prendono il nome di tensioattivi. Una tensione superficiale ridotta è desiderabile nei liquidi impiegati in operazioni di pulizia in quanto il liquido, frammentandosi più facilmente in minutissime gocce, si disperde con maggior facilità sul materiale che s'intende pulire.
I tensioattivi vengono schematicamente rappresentati con un circoletto (testa polare) ed una coda (apolare); le loro reciproche dimensioni rappresentano qualitativamente la prevalenza della frazione polare o apolare nella molecola: ad esempio, il tensioattivo A è più polare di B in quanto quest'ultimo ha una catena apolare più lunga.
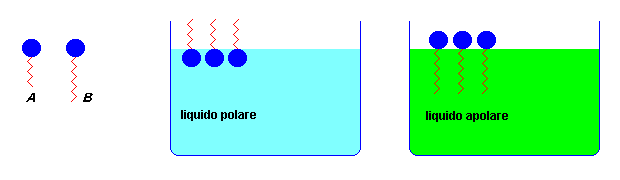
Supponiamo di aggiungere un tensioattivo in un recipiente contenente acqua; questo si disporrà sulla superficie dell'acqua inserendovi al sua testa polare, mentre la coda apolare, esseno insolubile in acqua, rimarrà verso l'esterno.
Nel caso lo stesso tensioattivo fosse aggiunto ad un liquido apolare (esano, benzene, ecc.), sarebbe la coda apolare ad inserirsi nello strato molecolare superficiale del liquido, lasciando la testa polare, non solubile, verso l'esterno.
Risulta evidente, in base a quanto discusso sulla natura della tensione superficiale, che la tendenza del tensioattivo a disporsi sulla superficie del liquido, sia esso polare o apolare, ne modificherà le interazioni molecolari superficiali.
 |
 |
|
| acqua distillata | 0,001 M | 0,002 M |
 |
 |
 |
| 0,003 M | 0,004 M | 0,005 M |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
testa e corpo ancóra asciutti |
|
|
|
|
|
|
|
|
Come dimostrano questi esperimenti (www.woodrow.org/teachers/bi/1998/waterstrider/student_lab.html), la contaminazione da detergenti anche a concentrazione molto basse (0.005M) è sufficiente ad impedire agli insetti pattinatori di sostenersi sulla superficie dell'acqua.
 Se immergiamo una cannuccia in acqua e poi vi soffiamo dentro, constateremo che l'acqua si dividerà in tante piccole goccioline. Ripetendo l'esperimento con dell'acqua saponata, soffiando nella cannuccia si otterranno delle bolle di sapone.
Se immergiamo una cannuccia in acqua e poi vi soffiamo dentro, constateremo che l'acqua si dividerà in tante piccole goccioline. Ripetendo l'esperimento con dell'acqua saponata, soffiando nella cannuccia si otterranno delle bolle di sapone.
Nel primo esperimento, l'acqua si dividerà in goccioline perché le molecole d'acqua sono legate strettamente tra di loro (forza di coesione) e non si "aprono" facilmente perché la tensione superficiale è molto forte. Nel secondo esperimento, l'aggiunta di sapone, che è un tensioattivo, abbassa la tensione superficiale e quindi le molecole tenderanno ad allontanarsi formando una pellicola elastica capace di gonfiarsi con l'aria.
l'aggiunta del sapone produce due effetti:
 |
 |
|
| (PM · v)2/3 · g = k · (tc - t) |
dove:
PM = peso molecolare del liquido (influenzato dal grado di associazione; es.
(H2O)n);
v = volume specifico;
g
= tensione superficiale;
tc = temperatura critica del liquido;
t = temperatura in oggetto;
k = costante = 2,12 · 10-7 J/K
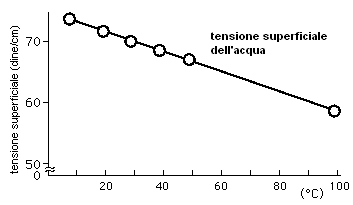
La tabella in basso a sinistra mostra i valori della tensione superficiale di alcune sostanze. Il grafico in basso a destra illustra la variazione della tensione superficiale con la temperatura. La tensione superficiale dell'acqua è 72 dine/cm a 25 0C. Questo significa che per rompere la pellicola superficiale è necessario applicare una forza di 72 dine su un tratto di 1 cm. L'elevata tensione superficiale dell'acqua è legata alla sua natura polare. L'acqua calda ha migliori proprietà detergenti giacché la sua minor tensione superficiale la rende un agente bagnante più efficace in quanto permette di raggiungere porosità e fessure piuttosto che aggirarle per effetto dell'elevata tensione superficiale.
|
 |
| 3 | ||||||||
Marcello Guidotti, copyright 2003-2004
questa pagina può essere riprodotta su qualsiasi supporto o rivista purché sia citata la fonte e l'indirizzo di questo sito (ai sensi degli artt. 2575 e 2576 cc. Legislazione sul diritto d'autore). Le fotografie sono tratte da siti web e sono, o possono ritenersi, di pubblico dominio purché utilizzate senza fini di lucro. Le immagini di prodotti presenti nel sito hanno unicamente valenza esemplificativa oltre che, eventualmente, illustrare messaggi fuorvianti e non vi è alcun richiamo diretto o indiretto alla loro qualità e/o efficacia il cui controllo è affidato alle autorità regolamentatorie.