| (2) v = dc/dt = - k [A] |
dove il segno negativo implica che la concentrazione iniziale diminuisce con il tempo.
E' bene sottolineare che l'ordine di reazione non deve suggerire una qualche relazione diretta tra esponenti e specie reagenti. Infatti, l'eq. 2 può riferirsi a due diverse reazioni:
Nel primo caso, A si trasforma in P e la reazione dipende evidentemente dalla sola concentrazione di A;
nel secondo caso, si consideri il seguente meccanismo:
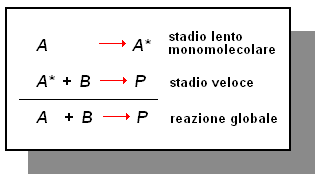
Se supponiamo che la reazione A + B ![]() P comporti una preventiva e lenta attivazione di A in A* (in modo da conferire ad A l'energia necessaria per reagire con B), allora questo è il passaggio (monomolecolare) che controlla la velocità dell'intero processo e la sua equazione cinetica è v = k [A].
P comporti una preventiva e lenta attivazione di A in A* (in modo da conferire ad A l'energia necessaria per reagire con B), allora questo è il passaggio (monomolecolare) che controlla la velocità dell'intero processo e la sua equazione cinetica è v = k [A].
Dopo che è avvenuta l'attivazione di A, in A*, la successiva reazione di A* con B per dare il prodotto P, procede velocemente.

Possiamo convincerci che lo stadio lento condizioni e determini la velocità di reazione, pensando ad una catena di montaggio: gli addetti che via via eseguono le varie manipolazioni, sono condizionati dalla velocità con cui ricevono i manufatti dagli operai più lenti.
L'eq. 2, in forma integrata, diventa:
| (3) ln c1/c2 = k t |
dove c1 e c2 sono le concentrazioni riferite ai tempi t1 = 0 e t2 = t
se poniamo c2 = c1/2, possiamo calcolare il tempo, t½ necessario perché la concentrazione iniziale si riduca alla metà:
| (4) ln 2/k = t½ |
questo significa che, in una reazione di primo ordine, qualunque sia la concentrazione iniziale, il tempo necessario perché questa si dimezzi è costante.
Per esempio, se un certo componente dimezza la sua concentrazione dopo 2 h, la sua concentrazione sarà ulteriormente dimezzata (ossia ridotta a 1/4) dopo altre due ore (ovverosia dopo 4 h dall'inizio)
| 2 | |||||
Marcello Guidotti, copyright 2003, 2007
questa pagina può essere riprodotta su qualsiasi supporto o rivista purché sia citata la fonte e l'indirizzo di questo sito (ai sensi degli artt. 2575 e 2576 cc. Legislazione sul diritto d'autore). Le fotografie sono tratte da siti web e sono, o possono ritenersi, di pubblico dominio purché utilizzate senza fini di lucro. Le immagini di prodotti presenti nel sito hanno unicamente valenza esemplificativa oltre che, eventualmente, illustrare messaggi fuorvianti e non vi è alcun richiamo diretto o indiretto alla loro qualità e/o efficacia il cui controllo è affidato alle autorità regolamentatorie.