| (11) |
| (11) |
 dove:
dove:
k = coefficiente di velocità;
T = temperatura assoluta (in gradi K);
R = costante dei gas (8,29 J);
A = fattore di frequenza;
E = energia di attivazione
ponendo l'equazione di Arrhenius in forma logaritmica, si ha:
| (12) |
I coefficienti A, E, non sono ricavabili con metodi teorici e sono anch'essi legati alla variazioni di temparatura; tuttavia, per escursioni termiche non molto ampie (verificabili sperimentalmente), si possono ritenere costanti. Questo fatto ci permette di scrivere due equazioni analoghe alla precedente: una con k1 e T1, l'altra con k2 e T2. Eguagliando le due equazioni così ottenute (si considera il coefficiente A costante), si ottiene:
(13) 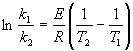 |
questa equazione permette di calcolare la costante cinetica di reazione ad una certa temperatura se è nota la costante per un'altra temperatura e l'energia di attivazione della reazione.
Tra due successive collisioni, le molecole di un gas si muovono con velocità costante secondo traiettorie rettilinee. La distanza media tra due urti successivi è detta cammino libero medio. Infatti le molecole, per quanto piccole, non sono punti matematici, bensì hanno una dimensione finita e si urtano tra loro. Questo significa che il cammino libero medio è in stretta relazione con le dimensioni molecolari e con il numero di particelle per unità di volume.
In un gas, le particelle non hanno tutte la stessa velocità, dato che le velocità molecolari cambiano in seguito agli urti reciproci (gli urti tra due particelle comportano il reciproco scambio delle velocità, ma gli urti fra tre particelle comportano variazioni delle singole velocità). La legge di distribuzione delle velocità di un gas costituito da un gran numero di particelle è stata trovata da James C. Maxwell, ed ha la formula seguente:
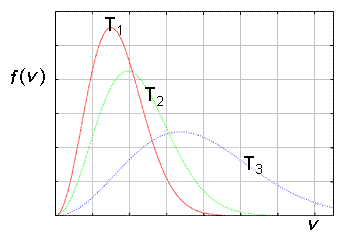 dove f(v) esprime la probabilità che una particella di massa m abbia una velocità compresa nell’intervallo infinitesimo v e v + dv. In questa formula, T è la temperatura e KB è la costante di Boltzmann. Al variare della temperatura, tutte queste curve hanno una forma tipica, mostrate nella figura a destra.
dove f(v) esprime la probabilità che una particella di massa m abbia una velocità compresa nell’intervallo infinitesimo v e v + dv. In questa formula, T è la temperatura e KB è la costante di Boltzmann. Al variare della temperatura, tutte queste curve hanno una forma tipica, mostrate nella figura a destra.
Si noti che all'aumentare della temperatura, il punto massimo della distribuzione si sposta a valori più alti della velocità, in accordo con l'interpretazione macroscopica della temperatura. L'intervallo delle velocità tipiche diviene più esteso, così che la distribuzione si allarga.
Poiché l'area sotto la curva deve restare invariata (essa è sempre uguale a 1, cioè al valore della somma di tutte le probabilità), la distribuzione deve necessariamente appiattirsi all'aumentare della temperatura. Quindi il numero di particelle aventi velocità maggiori di un determinato valore aumenta all'aumentare della temperatura. Ciò spiega in maniera semplice molti fenomeni, come l'aumento della velocità delle reazioni chimiche all'aumentare della temperatura. La distribuzione delle velocità delle molecole di un liquido ha caratteristiche simili. Questo rende ragione del fatto che a temperature molto al di sotto del normale punto di ebollizione alcune molecole di un liquido possano sfuggire dal recipiente. Infatti, solo quelle più veloci possono vincere l'attrazione delle molecole alla superficie e sfuggire per evaporazione. L'energia cinetica media delle rimanenti molecole corrispondentemente si abbassa, lasciando il liquido ad una temperatura più bassa. Questo è il motivo per cui l'evaporazione dà luogo a un processo di raffreddamento.
A titolo di esempio, la velocità media delle molecole di idrogeno a 0° C e alla pressione di 1 atm, vale v = 7200 km/h. Il cammino libero medio è però estremamente piccolo, dell'ordine di 10- 5cm. Ciascuna particella subisce, in media, infatti cinque miliardi di urti al secondo! La brevità del cammino libero medio e la frequenza delle collisioni danno l'illusione che il gas sia un qualcosa di continuo (si pensi ad un pallocino per bambini: è l'elevata frequenza degli urti a mantenerlo in tensione), mentre in realtà esso è costituito da un numero enorme di particelle in incessante movimento.
La velocità di una reazione non è generalmente determinata unicamente dal numero di urti fra le molecole in un certo tempo. Ciò è dimostrato dall'evidenza che certe reazioni sono molto rapide ed altre, apparentemente simili, sono lente. E questo benché il numero degli urti sia quasi identico. Pertanto, si deve concludere che solo una frazione degli urti fra le molecole dà luogo ad una reazione.
Il chimico Svante Arrhenius (1859-1927) avanzò l'ipotesi che le molecole collidenti (o che si decompongono), per reagire devono possedere un'energia superiore alla media. Questo eccesso di energia è detto energia di attivazione della reazione e può essere costituito da energia cinetica (le molecole si urtano con un'energia maggiore della media) o da energia interna delle molecole, come nel caso della loro decomposizione.
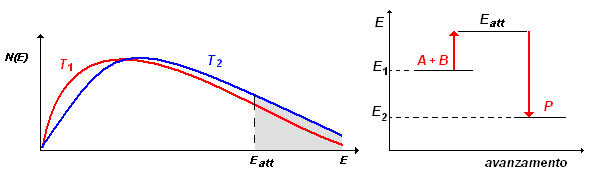
I grafici sopra riportati, visualizzano la situazione:
si consideri, per esempio, la reazione A + B ![]() P. Come mostra il diagramma a destra, perché A reagisca con B è necessario che il loro urto reciproco avvenga con un'energia almeno paria a Eatt , dando luogo ad un prodotto P con energia minore di quella dei reagenti.
P. Come mostra il diagramma a destra, perché A reagisca con B è necessario che il loro urto reciproco avvenga con un'energia almeno paria a Eatt , dando luogo ad un prodotto P con energia minore di quella dei reagenti.
Ora, si faccia riferimento al grafico a sinistra: ad ogni intervallo di energia ΔE, corrisponde un numero di molecole N(E) aventi quella energia; aumentando la temperatura, la curva dell'energia si deforma (profili in rosso e in blu) mantenendo però costante l'area da essa sottesa.
La curva colorata in rosso corrisponde alla distribuzione dell'energia alla temperatura T1; la curva colorata in blu corrisponde alla distribuzione dell'energia alla temperatura T2: si vede facilmente che alla temperatura T2 > T1 è maggiore il numero di molecole, N(E), che ha energia maggiore di Eatt (parte colorata in grigio). Questa è la ragione per cui si ha un aumento di velocità della reazione.
 |
 La velocità della maggior parte delle reazioni chimiche viene circa raddoppiata per ogni 10 ºC di aumento della temperatura.
La velocità della maggior parte delle reazioni chimiche viene circa raddoppiata per ogni 10 ºC di aumento della temperatura.
Questa utile regola è approssimativa: talvolta ad un aumento di 10 ºC corrisponde un incremento di velocità minore o maggiore; le reazioni delle molecole di grandi dimensioni (ad es. le proteine), possono subire incrementi molto maggiori. Per esempio, la velocità di coagulazione delle ovoalbumine aumenta di circa 50 volte per un aumento di 10 ºC.
 Michael Dewar, propose un esempio insolito per visualizzare il fatto che la velocità di rezione raddoppia ogni 10 gradi di temperatura. I processi vitali delle formiche sono reazioni chimiche e si conformano alle leggi della chimica generale. Se osserviamo le formiche vediamo che sono molto attive e invadenti alla luce del sole, mentre il loro ritmo si riduce quando entrano in una zona d'ombra. Quando la temperatura passa da 20 a 30 ºC, la loro attività approssimativamente raddoppia. La formica potrebbe servire come termometro, in quanto misurandone la velocità si potrebbe stimare con una certa approssimazione la temperatura ambiente.
Michael Dewar, propose un esempio insolito per visualizzare il fatto che la velocità di rezione raddoppia ogni 10 gradi di temperatura. I processi vitali delle formiche sono reazioni chimiche e si conformano alle leggi della chimica generale. Se osserviamo le formiche vediamo che sono molto attive e invadenti alla luce del sole, mentre il loro ritmo si riduce quando entrano in una zona d'ombra. Quando la temperatura passa da 20 a 30 ºC, la loro attività approssimativamente raddoppia. La formica potrebbe servire come termometro, in quanto misurandone la velocità si potrebbe stimare con una certa approssimazione la temperatura ambiente.
Consideriamo, per esempio, la reazione A + B ![]() P. Supponiamo che questa reazione sia di primo ordine in conseguenza di uno stadio lento monomolecolare:
P. Supponiamo che questa reazione sia di primo ordine in conseguenza di uno stadio lento monomolecolare:
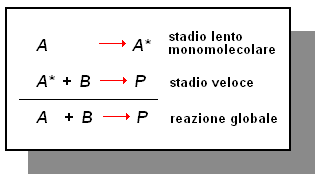
Supponiamo che la presenza di un catalizzatore faciliti lo stadio lento, rendendolo più veloce dello stadio successivo. In tal caso, il meccanismo di reazione diventa:
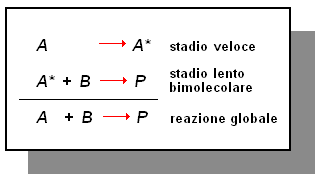
Dunque, la presenza del catalizzatore aumenta la velocità di reazione in quanto fà sì che la reazione A + B ![]() P avvenga con un meccanismo diverso.
P avvenga con un meccanismo diverso.
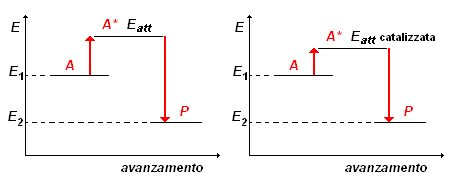 come si vede dai grafici, la stessa reazione in presenza di un catalizzatore (diagramma a destra) comprende almeno uno stadio determinante per la reazione per il quale è richiesta un'energia di attivazione minore di quella richiesta in assenza del catalizzatore (diagramma a sinistra). |

| 5 | |||||
Marcello Guidotti, copyright 2003-2010-2011
questa pagina può essere riprodotta su qualsiasi supporto o rivista purché sia citata la fonte e l'indirizzo di questo sito (ai sensi degli artt. 2575 e 2576 cc. Legislazione sul diritto d'autore). Le fotografie sono tratte da siti web e sono, o possono ritenersi, di pubblico dominio purché utilizzate senza fini di lucro. Le immagini di prodotti presenti nel sito hanno unicamente valenza esemplificativa oltre che, eventualmente, illustrare messaggi fuorvianti e non vi è alcun richiamo diretto o indiretto alla loro qualità e/o efficacia il cui controllo è affidato alle autorità regolamentatorie.