profarmaci
Una molecola farmacologicamente attiva, benché dotata di caratteristiche idonee a produrre una certa risposta terapeutica, non necessariamente possiede le migliori proprietà - connesse alla sua struttura molecolare - per essere trasportata intatta dal sito di somministrazione al suo sito di azione.
Generalmente, solo una piccola frazione della dose somministrata raggiunge il sito bersaglio e, poiché la maggior parte del farmaco è libera di interagire con altri sistemi recettoriali presenti in altri siti non-bersaglio, spesso una limitata efficacia è solo il minore ed il più augurabile dei rischi.
Sulla base di questa osservazione, per cercare di individuare una soluzione non sempre possibile con lavorazioni tecnologiche di sostanze farmaceutiche, la ricerca si è orientata ai profarmaci.

Il termine profarmaco (pro-drug) definisce un composto non dotato di una sua intrinseca attività farmacologica ma che diventa attivo dopo aver subìto una biotrasformazione di tipo chimico od enzimatico. Il profarmaco costituisce pertanto il precursore del farmaco, rappresentato dal suo metabolita.
Per migliorare il potenziale terapeutico dei farmaci, si rivela spesso vantaggiosa la modificazione chimica della molecola farmacologicamente attiva mediante l'inserimento di derivatizzazioni su alcuni gruppi funzionali
Infatti, con il progredire degli studi clinici, è apparso sempre più evidente che la somministrazione ed i successivi processi di trasporto delle sostanze terapeutiche al loro sito di azione, possono in molti casi essere scarsamente efficienti in quanto sono destinati ad organismi estremamente soggetti a diversificazioni funzionali e strutturali.
Un discreto numero di medicamenti, storicamente anche molto importanti, è stato utilizzato senza la comprensione che il principio attivo in realtà fosse costituito da uno dei loro metaboliti: per questi farmaci è stato coniamto il termine di "profarmaci accidentali". Per esempio, l'attività del Prontosil (sulfamidico) deriva dal suo prodotto di scissione, la Sulfanilammina.
Dal punto di vista strutturale e funzionale, le caratteristiche di un profarmaco possono essere così riassunte:
- la parte attiva del profarmaco è legata ad un gruppo vettore temporaneo atraverso un legame covalente, degradabile in vivo attraverso una reazione chimica o enzimatica;
- il profarmaco è farmacologicamente inattivo o molto meno attivo del suo prodotto di scissione metabolica o idrolitica;
- il gruppo vettore, dopo la scissione, non deve possedere una propria attività o tossicità;
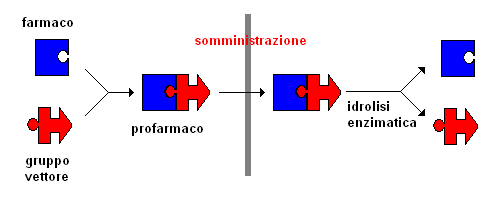
rappresentazione schematica del meccanismo di azione di un profarmaco. |
- la rigenerazione del farmaco attivo dal profarmaco deve essere rapida e preponderante, in termini di cinetica, sulle reazioni di degradazione metabolica del profarmaco stesso o del suo metabolita attivo.
Una rigorosa applicazione della definizione di profarmaco porta quindi alla esclusione dei profarmaci accidentali di sostanze quali l'acido acetil-salicilico o la codeina; in quanto, pur essendo queste in grado di liberare metaboliti di estrema efficacia quali l'acido salicilico e la morfina, sono già dotate di una propria e non trascurabile azione farmacologica allo stato di precursori.
Dal punto di vista chimico, la tecnologia dei profarmaci rappresenta l'analogo della tecnica della protezione dei gruppi reattivi molto usata nelle sintesi chimiche: analoghi sono infatti i concetti di protezione selettiva e mirata al conferimento di proprietà particolari e prevedibili dal punto di vista chimico-fisico, nonché di rigenerazione quantitativa del precursore in condizioni ben precise.
Le modificazioni delle caratteristiche chimico-fisiche, per i suoi riflessi sulle propriettà biofarmaceutiche e farmacocinetiche del farmaco, costituiscono la base razionale del ricorso ai profarmaci. Tuttavia, considerando le tre fasi (biofarmaceutica, farmacocinetica e farmacodinamica) che determinano la risposta terapeutica di un farmaco, l'approccio dei profarmaci è applicabile solo alle prime due.
Nella fase bioarmaceutica, concernente la scelta della via di somministrazione e della forma farmaceutica, anche piccole variazioni della struttura chimica possono comportare una efficace modulazione delle proprietà chimico-fisiche del principio attivo e, attraverso una alterazione di lipofilia, pKa e polarità, ottimizzarne la solubilità o la capacità di dissoluzione nei fluidi biologici, o il coefficiente di diffusione attraverso le membrane biologiche della cute o del canale gastrointestinale.
In sintesi, viene ad essere modificato, nella quantità e nella velocità, il potenziale di assorbimento della molecola attiva.
Nella fase farmacocinetica, il farmaco deve raggiungere in un tempo adeguato il sito di azione cui è legata l'attività terapeutica. Anche in questa fase, ed in misura ancóra maggiore che nella fase precedente, l'alterazione delle caratteristiche chimico-fisiche della sostanza mediante una derivatizzazione chimica di alcuni suoi gruppi funzionali, può determinare variazioni notevoli nella cinetica dei fenomeni di trasporto e di distribuzione con evidenti variazioni metaboliche.
Nella fase farmacodinamica, invece, poiché è proprio la struttura molecolare del farmaco a produrre, mediante attivazione del sistema recettoriale specifico, la modificazione funzionale temporanea delle cellula bersaglio, qualsiasi modificazione chimico strutturale, può comportare una perdita di efficacia se altera la perfetta complementarietà fra farmaco e recettore. In questa fase, pertanto, l'approccio del profarmaco può risulta inefficace.
applicazioni pratiche
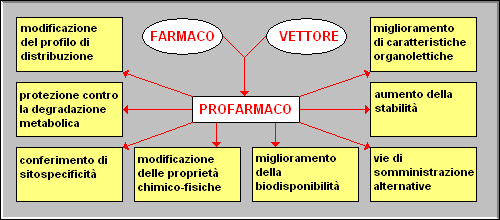
Esaminando qualche esempio pratico di applicazione dei profarmaci, appaiono evidenti i vantaggi che questa strategia può apportare al potenziale terapeutico di un farmaco.
Le ampicilline orali costituiscono un ottimo esempio di efficacia dei profarmaci nel consentire un miglioramento della biodisponibilità dei farmaci. L'ampicillina, infatti, rappresenta il caso tipico di un antibiotico attivo per via orale grazie alla sua stabilità in ambiente gastrico, e tuttavia caratterizzato da una percentuale di assorbimento limitata: all'incirca solo 1/3 della dose somministrata viene assorbito.
In questo caso, l'esterificazione della funzione carbossilica della molecola ha portato alla sintesi di profarmaci di minore polarità e maggiore lipofilia in grado di essere assorbiti pressoché quantitativamente.
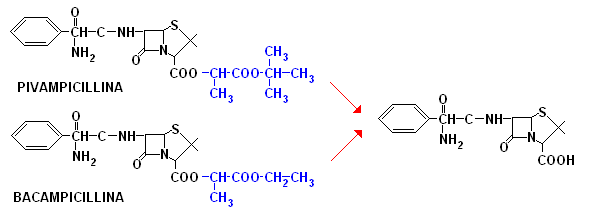
La pivampicillina, la bacampicillina e la talampicillina (non in figura), sono profarmaci rapidamente idrolizzati dalle esterasi e rigenerano nel sangue il metabolita attivo: l'ampicillina. Il miglioramento di biodisponibilità conseguente all'aumento della frazione assorbita permette di ridurre la dose di somministrazione per os alla metà circa di quella dell'ampicillina stessa.
Oltre a migliorare le caratteristiche già presenti, la tecnica dei profarmaci può anche consentire vie di somministrazione che sarebbero vietate al farmaco per via di una insufficiente solubilità in acqua in condizioni quasi fisiologiche. E' il caso questo, solo per citare esempi significativi, degli esteri in posizione 21 del nucleo steroideo dei corticosteroidi: i corticoderivati fostato, succinato, metansolfonato e altri ancóra consentono infatti, grazie alla loro buona solubilità, la preparazione di forme iniettabili di rapida efficacia e questo rappresenta un indubbio vantaggio per le terapie d'urgenza degli stati infiammatori o degli episodi allergici.
L'approccio dei profarmaci può essere utile anche per migliorare la solubilità in vitro, mascherare odori e sapori sgradevoli, ridurre la volatilità.
Infine, la derivatizzazione bioreversibile dei gruppi funzionali della molecola attiva, suscettibili di attacco metabolico, permette a volte di superare il grosso problema della sua inattivazione metabolica operata dagli enzimi presenti nella mucosa intestinale o nel primo passaggio attraverso il fegato. Un esempio è rappresentato dalla L-Dopa e dalla terbutalina, i cui profarmaci permettono un aumento della biodisponibilità da 2 a 4 volte.
ombrelli molecolari
Una delle funzioni della cellula è ostacolare il passaggio alle molecole estranee. Però, questo comporta che siano anche protette dall'azione dei benefici prodotti da alcuni farmaci. Moltissimi farmaci sono costituiti da molecole relativamente grandi, come i peptidi; per esempio,
brevi frammenti di acidi nucleici hanno fondamentalmente lo stesso materiale del DNA e possono aiutare a regolare il comportamento dei geni. Proprio la tecnica della terapia genica che mira a correggere difetti genetici della cellula, richiede che frammenti di DNA siano "contrabbandati" nella cellula.
Tuttavia, trasferire una molecola dall'ambiente acquoso esterno alla cellula a quello interno, citoplasmatico, è difficoltoso. La cellula è costituita da due strati molecolari lipidici simili a catene e disposti in modo da presentare le loro teste idrofile alle superfici esterna ed interna della membrana e lasciando le parti lipofile nell'interno. I peptidi e gli acidi nucleici non possono penetrare facilmente questa regione interna lipofila della membrana. Alcuni tentativi hanno cercato come risolvere questo problema, per esempio utilizzando virus inattivati che sono specializzati nell'attraversare la membrana cellulare.
Steven Regen and collaboratori della Lehigh University in Pennsylvania hanno avuto l'idea di costruire il cosiddetto "ombrello molecolare" (molecular umbrella) che si chiude attorno ad una molecola proteggendola nell'attraversare la membrana ed in grado di riaprirsi rilasciando la molecola dopo averla attraversata.
Questi strani ombrelli, sebbene si aprano solo in ambiente acquoso, come vedremo, espongono il loro passeggero all'acqua piuttosto che ripararlo.
Per generare un ombrello che si apra automaticamente negli ambienti acquosi, richiudendosi in quello oleosi, è stato utilizzato l'acido colico, che è caratterizzato da una struttura molecolare a due facce: una faccia interna idrofila e una faccia esterna lipofila.
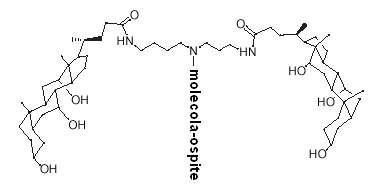
L'acido colico è uno dei principali acidi nei mammiferi. E' commercialmente disponibile a basso costo. Inoltre, ha una struttura molecolare con alcune caratteristiche speciali, come l'anfifilicità. L'acido carbossilico e i tre gruppi idrossilici possono agire come appigli sintetici. Per queste ragioni l'acido colico può costituire un veicolo per nuove molecole attive. Uno di questi esempi è mostrato nella figura accanto.
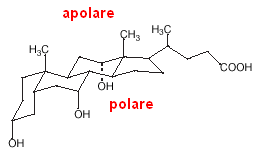 La struttura degli acidi biliari è differente da quella del classico tensioattivo testa-coda: in questo caso (v. fig. a sx), la parte idrofila è costituita da tre ossidrili alcolici mentre la parte lipofila è lo scheletro steroideo privo di funzionalità polari.
La struttura degli acidi biliari è differente da quella del classico tensioattivo testa-coda: in questo caso (v. fig. a sx), la parte idrofila è costituita da tre ossidrili alcolici mentre la parte lipofila è lo scheletro steroideo privo di funzionalità polari.
L'anfifilicità, come detto, è utilizzata nei cosiddetti "ombrelli molecolari" (molecular umbrella), strutture capaci di veicolare una molecola polare attraverso il doppio strato di una membrana schermandola dall'ambiente con una o più unità di acido colico. L'ombrello è formato da due molecole che ricordano due foglie leggermente curve, sulle facce concave di cui sono fissati i gruppi molecolari idrofili. Le "foglie" che si uniscono insieme, sono unite da una catena di collegamento: il "mozzo" dell'ombrello, al quale si può legare la molecola da veicolare nella cellula.
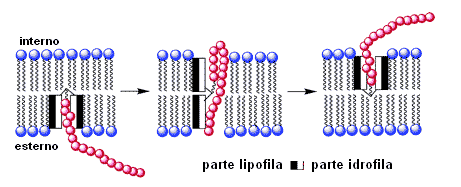
Nell'attraversare la membrana, in una prima fase, l'ombrello si rovescia lasciando esposto il gruppo da veicolare e poi si richiude permettendo il completamento del processo di trasporto. |
In acqua il complesso si presenta con le "foglie" aperte, esponendo le facce idrofile. Ma in un mezzo oleoso simile all'interno della membrana cellulare, le foglie racchiudono la molecola da trasportare in modo da esporre solo le facce esterne apolari. Questa diposizione rende l'ombrello molecolare chiuso compatibile con le code lipidiche, permettendo alla molecola i passare liberamente attraverso la parete delle cellule. Dall'altra lato, l'ombrello si apre quando entra in contatto con il citoplasma. Il legame della molecola con l'ombrello può allora essere tagliato con adatte reazioni in modo da liberare la molecola all'interno della cellula.
Questi ombrelli si sono dimostrati dei buoni vettori per trasportare molecole altamente polari, per esempio oligonucleotidi e peptidi, attraverso membrane fosfolipidiche di liposomi sintetici usati come modelli delle cellule di mammifero.
Janout, V., Di Giorgio, C. & Regen, S. R. Molecular Umbrella-Assisted Transport of a Hydrophilic Peptide Across a Phospholipid Membrane. Journal of the American Chemical Society 122, 26712672 2000.
Marcello Guidotti, copyright 2004-2006
questa pagina può essere riprodotta su qualsiasi supporto o rivista purché sia citata la fonte e l'indirizzo di questo sito (ai sensi degli artt. 2575 e 2576 cc. Legislazione sul diritto d'autore). Le fotografie sono tratte da siti web e sono, o possono ritenersi, di pubblico dominio purché utilizzate senza fini di lucro. Le immagini di prodotti presenti nel sito hanno unicamente valenza esemplificativa oltre che, eventualmente, illustrare messaggi fuorvianti e non vi è alcun richiamo diretto o indiretto alla loro qualità e/o efficacia il cui controllo è affidato alle autorità regolamentatorie.




 La struttura degli acidi biliari è differente da quella del classico tensioattivo testa-coda: in questo caso (v. fig. a sx), la parte idrofila è costituita da tre ossidrili alcolici mentre la parte lipofila è lo scheletro steroideo privo di funzionalità polari.
La struttura degli acidi biliari è differente da quella del classico tensioattivo testa-coda: in questo caso (v. fig. a sx), la parte idrofila è costituita da tre ossidrili alcolici mentre la parte lipofila è lo scheletro steroideo privo di funzionalità polari.
