il flusso osmotico si arresta quando si crea un dislivello tale che l'aumento di pressione idrostatica conseguente all'ingresso di solvente, contrasta la pressione osmotica.
 il flusso osmotico si arresta quando si crea un dislivello tale che l'aumento di pressione idrostatica conseguente all'ingresso di solvente, contrasta la pressione osmotica. |
Riassumiamo le differenze nel comportamento dei due esperimenti:
Il processo descritto nel secondo esperimento, prende il nome di osmosi (dal greco osmòs = spinta). In questo caso, la diffusione dell'acqua attraverso una membrana semipermeabile può sembrare un fenomeno diverso dalla diffusione libera di molecole di soluto; tuttavia, entrambi i processi avvengono secondo lo stesso principio generale: la diffusione avviene nella direzione che tende a rendere uguali le pressioni nei due scomparti o recipienti. Ciò costituisce per il solvente il gradiente necessario perché avvenga la diffusione attraverso la membrana.
L'analogo processo diffusivo che si dovrebbe verificare anche per il soluto, viene impedito dalla membrana che non ne permette il passaggio. Così, attraverso la membrana passa unicamente il solvente che diluisce la soluzione fino ad annullare il gradiente sopra definito.
Per completezza, si deve spiegare la ragione del dislivello del liquido fra i due recipienti. Questo si produce in quanto il numero di molecole d'acqua che statisticamente colpiscono e attraversano la membrana proveniendo dal recipiente di sinistra (solo solvente) è maggiore del numero di molecole provenienti dal recipiente di destra (soluzione = solvente + soluto): una parte delle molecole che colpiscono la membrana è costituita dalle molecole di soluto e queste non sono in grado di attraversarla. Questo effetto è legato alla concentrazione di soluto ed è tanto maggiore quanto più elevato è il numero di molecole che lo costituiscono (v. soluzione ORT).
Vediamo in dettaglio: sia P1 la pressione diffusiva nel recipiente di sinistra (solo solvente); P2 nel recipiente di destra (soluzione). La pressione nel recipiente di destra è data dalle molecole di acqua (solvente), PA, e saccarosio (soluto), PS. Per l'equilibrio deve essere P1 = P2 = PA + PS, ma poiché la pressione del soluto, PS, non può partecipare al processo diffusivo, segue che P1 > P2. Questo significa che per l'equilibrio nella parte della soluzione deve essere presente una pressione idrostatica (dgh), legata alla densità, d, della soluzione tale da compensare la ridotta pressione diffusiva (P1 = P2 + dgh).
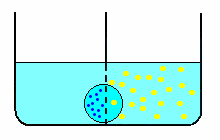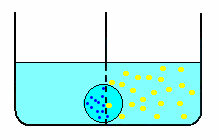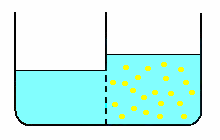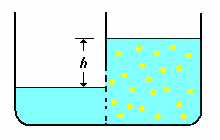
| nella diffusione libera, le molecole di soluto (schematizzate in blu) diffondono attraverso la membrana fino ad equilibrare le concentrazioni nei due scomparti. | 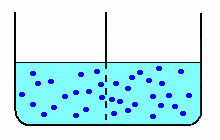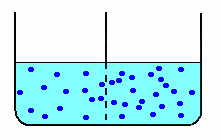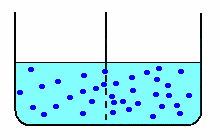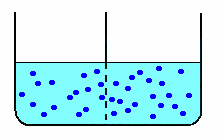 |
Il comportamento osmotico è conseguente alla particolare struttura della membrana, che è selettiva e per questo viene detta semipermeabile. In pratica, la membrana semipermeabile è caratterizzata da spazi intermolecolari di dimensioni tali che permettono solo il passaggio delle molecole d'acqua e non delle molecole di soluto (saccarosio) molto più voluminose.
Nella diffusione libera, ottenuta con una membrana di caratteristiche tali da permettere il passaggio anche al soluto, anche le molecole di zucchero diffondono nell'acqua pura, aumentando la concentrazione di zucchero nello scomparto a concentrazione minore e diminuendo la concentrazione in quello a concentrazione maggiore.
| π = c · R · T · i |
dove:
R = costante dei gas = 0.0820 [l][atm][mol] -1 [K] -1;
T = temperatura assoluta in K;
c = concentrazione della soluzione [mol] [l] -1;
i = fattore di correzione che tiene conto del numero di molecole in soluzione (derivanti dalla eventuale dissociazione del soluto);
|
esempio 1: determinare la pressione osmotica a 23°C di una soluzione 0.15 M di cloruro di calcio.
Dalla dissociazione del cloruro di calcio:
CaCl2 si vede che il fattore di correzione è i = 3 (somma di una molecola di Ca ++ e due molecole di Cl –), per cui la pressione osmotica sarà: π = c· R · T · i = 0.15 [mol/l] · 0.082 [l·atm/mol·K] · 296 [K] · 3 = 10.922 atm |
 La pressione osmotica in un liquido nel quale sono disciolte più sostanze è ancóra fornita dall'equazione di Van't Hoff. In questo caso, la concentrazione, c, deve rappresentare la concentrazione totale di tutte le particelle che non possono attraversare la membrana. Questa concentrazione prende il nome di osmolarità della soluzione. Il suo valore è dato dalla somma di tutte le particelle che non attraversano la membrana. Soluzioni con la stessa osmolarità della cellula sono dette isosmotiche.
La pressione osmotica in un liquido nel quale sono disciolte più sostanze è ancóra fornita dall'equazione di Van't Hoff. In questo caso, la concentrazione, c, deve rappresentare la concentrazione totale di tutte le particelle che non possono attraversare la membrana. Questa concentrazione prende il nome di osmolarità della soluzione. Il suo valore è dato dalla somma di tutte le particelle che non attraversano la membrana. Soluzioni con la stessa osmolarità della cellula sono dette isosmotiche.
|
esempio 2: l'osmolalità del liquido intracellulare è 0.3 osmo/l. Questo significa che in un litro di questo liquido vi sono 0.3 · N ( N = numero di Avogadro = 6 1023) = 1.8 1023 molecole che non attraversano la membrana. La pressione osmotica del liquido intracellulare è dunque: π = 0.30 [osmo/l]· 0.082 [atm·l/mol·K] · (273 + 37 °)[K] = 7.9 atm |
|
esempio 3: determinare il peso molecolare dell'emoglobina sapendo che 12.8968 g di questa proteina sciolti in 200 ml di acqua presentano una pressione osmotica di 0.25 atm a 27 ºC.
PM = (12.8968 · 0.082 · 300)/(0.2 · 0.25) = 64000 |

| % glucosio | volume (ml) |
| 0 acqua pura | 64 |
| 5 | 60 |
| 8 | 55 |
| 10 | 47 |
| 15 | 36 |
| 20 | 20 |
| Tipo e volume di bevanda che transita attraverso lo stomaco in 20 minuti (da R.J. Maughan, 1991 mod.) |
|
la maledizione di Montezuma
 L’infezione può essere provocata da diversi batteri, ma presenta sempre gli stessi sintomi: le scariche sono accompagnate da nausea, vomito, dolori addominali e febbre alta. Il più delle volte si tratta di disturbi che vanno via in pochi giorni senza che sia necessario ricorrere ai medicinali, ma possono essere sufficiente a rendere la vacanza un incubo. La miglior profilassi da seguire, richiede qualche semplice accorgimento: evitare verdure crude, gelati artigianali, carne e pesce se non sono ben cotti, acqua corrente e ghiaccio aggiunto alle bevande, frutta lavata con acqua corrente.
L’infezione può essere provocata da diversi batteri, ma presenta sempre gli stessi sintomi: le scariche sono accompagnate da nausea, vomito, dolori addominali e febbre alta. Il più delle volte si tratta di disturbi che vanno via in pochi giorni senza che sia necessario ricorrere ai medicinali, ma possono essere sufficiente a rendere la vacanza un incubo. La miglior profilassi da seguire, richiede qualche semplice accorgimento: evitare verdure crude, gelati artigianali, carne e pesce se non sono ben cotti, acqua corrente e ghiaccio aggiunto alle bevande, frutta lavata con acqua corrente.
La maledizione di Montezuma, è un modo per indicare quel terribile mal di pancia con conseguente diarrea e febbre altissima che rovina temporaneamente le vacanze a chi decide di visitare uno di quei Paesi eufemisticamente indicati come "in via di sviluppo".
Circa il 70% delle morti per diarrea sono causate da disidratazione derivante dalla perdita di grandi quantità di acqua e di sali dal corpo. Il corpo umano, per il suo corretto metabolismo, ha bisogno di acqua per mantenere sangue a sufficenza ed altri liquidi. Sostanzialmente se il vostro corpo perde più liquidi di quelli che state assumendo, stata disidratandovi.
Non esiste un farmaco sicuro ed efficace che possa arrestare questo disturbo. Tuttavia, le morti di tre milioni di bambini all'anno potrebbero essere evitate con un metodo che è poco costoso, sicuro e così semplice da poter essere appreso ed usato da tutti i genitori. Questo trattamento, praticabile nei casi che non richiedono ricovero, è la cosiddetta terapia orale di reidratazione (ORT = Oral Rehydration Therapy).
I microrganismi che causano la diarrea, interferiscono con i processi biochimici che regolano lo scambio di fluidi tra le pareti intestinali ed il circolo sanguigno. La terapia di reidratazione orale (ORT), è basata sulla somministrazione, ogni 3 - 4 ore, di piccoli volumi di liquido (per evitare il vomito) costituito da una soluzione acquosa di NaCl e glucosio. Tra il 1980 e il 1990, la ORT, unitamente a vaccini migliorati hanno ridotto di circa tre milioni il numero di decessi causati dalle principali malattie infantili nei paesi in via di sviluppo.In pratica, la ORT consiste nel bere una semplice soluzione per rimpiazzare l'acqua ed i sali persi dal corpo durante la diarrea. Questa soluzione (una poltiglia molto liquida) può essere preparate con ingredienti comunemente disponibili in famiglia: acqua mescolata con cereali (mais, riso, orzo, segale, avena), con una spesa di circa 50 centesimi.
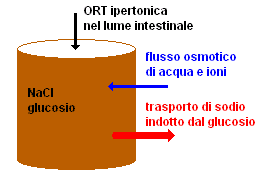
La soluzione ORT ha la proprietà di far passare per osmosi l'acqua dalla parete intestinale al sangue, in modo da ridurre la disidratazione. Esaminiamone, in base ai princìpi dell'osmosi, tre possibili composizioni:
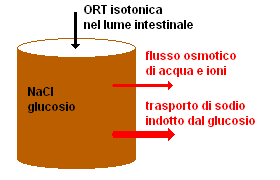 ORT isotonica: la concentrazione di cloruro di sodio e glucosio è aggiustata in modo da avere la stessa osmolalità del sangue. Il glucosio induce con un processo biochimico il trasporto del sodio verso il sangue (quindi non per osmosi), e con il sodio viene trascinata l'acqua diminuendo la disidratazione. Tuttavia, questo trattamento è sintomatico: non ha alcuna influenza sulle cause della diarrea e dunque non ne riduce né la durata né l'entità.
ORT isotonica: la concentrazione di cloruro di sodio e glucosio è aggiustata in modo da avere la stessa osmolalità del sangue. Il glucosio induce con un processo biochimico il trasporto del sodio verso il sangue (quindi non per osmosi), e con il sodio viene trascinata l'acqua diminuendo la disidratazione. Tuttavia, questo trattamento è sintomatico: non ha alcuna influenza sulle cause della diarrea e dunque non ne riduce né la durata né l'entità.
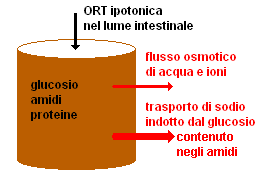
Nel prossimo decennio le morti di 20 milioni di bambini potrebbero essere evitate con l'uso della reidratazione orale. Il giornale medico britannico, The Lancet lo ha definito «... possibilmente la scoperta medica più grande di questo secolo.» Nessun'altra singola innovazione medica del ventesimo secolo ha il potenziale di impedire tante morti, in così breve tempo ed a un così basso costo.
L'acqua che beviamo è anche utilizzata dai reni per estrarre dal sangue i metaboliti di scarto del nostro organismo, che vengono eliminati attraverso l'urina. Per compiere questo processo, i reni richiedono una concentrazione di sali non superiore al 2 per cento. L'acqua marina contiene sali al 3,5 per cento; quindi, per esempio, bevendone un litro i nostri reni hanno bisogno di circa un altro mezzo litro di acqua per diluirlo. Per far questo, prelevano il liquido mancante dal nostro organismo e la sensazione di sete e disidratazione possono solo aumentare.
Infatti, nel nostro organismo sali e acqua sono in equilibrio osmotico: se all'interno delle cellule c'è più sale che nel plasma, l'acqua del plasma penetrerà nelle cellule fino a ristabilire l'equilibrio, mentre se la concentrazione è più elevata nel plasma le cellule si svuoteranno cedendo acqua al plasma.
Così, se assumiamo acqua priva di sali le cellule si gonfiano, mentre se l'acqua è troppo salata le cellule si svuotano dell'acqua che contengono per cederla al plasma e si atrofizzano. L'organismo, in conseguenza della disidratazione, entra in uno stato di tossicosi e se si introduce altra acqua salata invece di quella dolce subentrano gravi disfunzioni renali dalle quali, alla fine, deriva la morte.
 ... Però gli eschimesi bevono il ghiaccio fuso e questo deriva dall'acqua di mare. Come è possibile? L'acqua ghiacciata è formata dalla condensazione del vapore acqueo alla superficie dell'acqua che non contiene sali e forma un sottile strato solido. L'acqua sotto questo strato solido è salata e questo la rende più densa, ne fa abbassare il suo punto di congelamento e quindi riduce l'evaporazione; allo stesso tempo quest'acqua legata al sale, essendo più pesante dell'acqua sottostante, affonda lasciando il posto a quella meno salata che affiora. Questa, a sua volta evapora e il processo si ripete (per visualizzare il fenomeno, si può pensare a dei piccoli cubetti di ghiaccio che intrappolano sale: questi cubetti affondano e contemporaneamente affiorano altrettanti cubetti con una minor quantità di sale intrapolato). Ovvamente i tempi sono piuttosto lunghi: qualche anno.
... Però gli eschimesi bevono il ghiaccio fuso e questo deriva dall'acqua di mare. Come è possibile? L'acqua ghiacciata è formata dalla condensazione del vapore acqueo alla superficie dell'acqua che non contiene sali e forma un sottile strato solido. L'acqua sotto questo strato solido è salata e questo la rende più densa, ne fa abbassare il suo punto di congelamento e quindi riduce l'evaporazione; allo stesso tempo quest'acqua legata al sale, essendo più pesante dell'acqua sottostante, affonda lasciando il posto a quella meno salata che affiora. Questa, a sua volta evapora e il processo si ripete (per visualizzare il fenomeno, si può pensare a dei piccoli cubetti di ghiaccio che intrappolano sale: questi cubetti affondano e contemporaneamente affiorano altrettanti cubetti con una minor quantità di sale intrapolato). Ovvamente i tempi sono piuttosto lunghi: qualche anno.
Nelle regioni polari, il vapore congela immediatamente a causa della bassa temperatura dell'aria. I cristalli di ghiaccio formano sulla superficie una poltiglia deliquescente e si aggregano in placche di circa un metro di diametro, che si uniscono e formano lastroni di ghiaccio giovani. Alla fine, quando la temperatura dell'atmosfera è sufficientemente bassa, i lastroni si uniscono per dare origine alla banchisa polare.
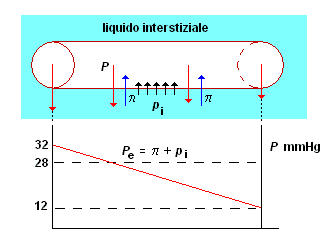
L'osmosi riveste un ruolo essenziale nello scambio di sostanze, a livello dei capilari, tra plasma e liquido interstiziale. In figura a destra, è schematizzato un capillare (le cui pareti sono costituite da una membrana semiperneabile) immerso nel liquido interstiziale.
All'interno del capillare scorre il liquido plasmatico, costituito dallo stesso liquido esterno, con l'aggiunta di un soluto (proteine del sangue) per le quali la parete del capillare è impermeabile. La presenza delle proteine comporta una maggiore concentrazione all'interno del capillare e quindi una pressione oncotica, π, che tende a richiamare nel capillare il liquido esterno con un processo articolato secondo lo schema seguente:
|
2) a causa della viscosità del sangue, la pressione P nel capillare diminuisce gradualmente nel senso del moto (grafico sotto la figura) e contemporaneamente la pressione oncotica interna al capillare cresce a causa dell'aumento di concentrazione dovuto alla fuoriuscita di solvente. Per conseguenza, all'interno del capillare, esiste una sezione in corrispondenza della quale la pressione, P, del liquido interno eguaglia la somma della pressione oncotica e la pressione dovuta al liquido interstiziale: Pe = π + pi. Da questa sezione in poi, e fino al termine del capillare, si avrà il rientro del solvente nel capillare (in quanto P < π + pi)
3) come risultato, nell'ambiente esterno al capillare (liquido interstiziale), si instaura un flusso di liquido che, uscendo dal tratto a monte del capillare, vi rientra nella parte più a valle. Questo continuo flusso di liquido lambisce le cellule dei tessuti apportandovi nuovo nutrimento e permettendo la raccolta dei prodotti di rifiuto.
Nel complesso equilibrio di pressioni alla base di questo processo di scambio dei fluidi, è evidente l'importanza della concentrazione delle proteine (pressione oncotica) nel sangue che fluisce nel capillare stesso.
 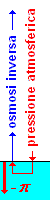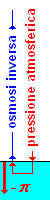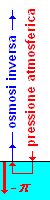 |
L'osmosi inversa si presenta in natura nelle mangrovie che crescono in acqua di mare. La linfa interna allo xilema, è costituita essenzialmente di acqua pura, mentre le radici affondano in acqua salata. Pertanto essendo l'osmolalità dell'acqua di mare = 1,08 osm/l, si può calcolare che deve esserci una differenza di pressione osmotica (π = c R T = 1,08 · 0.0820 · 293 = 25,9 atm) la quale dovrebbe spingere l'acqua fuori dall'albero immettendola nell'acqua salina e disidratando la pianta.
In realtà, avviene il contrario, e dunque si deve avere un'osmosi inversa. Ora, la pressione osmotica (nel verso dall'acqua contenuta nello xilema, all'acqua del mare) è p = - 25,9 atm e pertanto, per avere osmosi inversa occorre appunto che all'interno dello xilema sia in qualche modo presente una pressione maggiore, px, in verso opposto, capace cioè di risucchiare l'acqua internamente allo xilema (osmosi inversa).
riepilogando: la pressione alla superficie del mare è p = 1 atm (la pressione esercitata da un fluido si propaga in tutte le direzioni, e dunque p è anche diretta verso l'alto, quindi opposta alla pressione osmotica il cui segno è negativo in quanto ha verso opposto a quello in cui crescono le ordinate); dunque: p + px- π = 0 ![]() px = - p + π = - 1 + 25,9 = 24,9 atm, una pressione (verso l'alto) capace appunto di risucchiare l'acqua.
px = - p + π = - 1 + 25,9 = 24,9 atm, una pressione (verso l'alto) capace appunto di risucchiare l'acqua.
Questo risultato - la cui spiegazione richiede alcuni richiami di fisiologia vegetale - porta a concludere che la pressione dell'acqua nello xilema della maggior parte degli alberi sia negativa, cioè che l'acqua trattenuta nello xilema sia in tensione: la pianta risucchia l'acqua tirandola verso l'alto come se fosse una sorta di colonna liquida continua.
Nei pesci d'acqua dolce il liquido più concentrato è quello che circola all'interno del loro corpo che, per evitare di rigonfiarsi a causa dell'acqua assorbita attraverso la pelle, deve espellere ogni giorno grandi quantità di liquido (circa 10 volte il suo peso) sotto forma di urina poco concentrata in sali.
Nei pesci d'acqua marina, che nuotano in un liquido assai più concentrato del loro sangue, c'è un continuo passaggio di liquido dal loro corpo all'acqua del mare e per conseguenza devono quindi bere continuamente per reintegrare il liquido perduto, espellendo poca uriima però molto concentrata dai sali accumulati.
 La stragrande maggioranza degli invertebrati marini come molluschi, coralli ed artropodi mantiene una concentrazione di sali assolutamente identica a quella dell'acqua di mare e quindi nessun passaggio osmotico caratterizza i loro semplici organismi, rendendoli incapaci di tollerare anche minime fluttuazioni della salinità e sono quindi vincolati al loro habitat naturale.
La stragrande maggioranza degli invertebrati marini come molluschi, coralli ed artropodi mantiene una concentrazione di sali assolutamente identica a quella dell'acqua di mare e quindi nessun passaggio osmotico caratterizza i loro semplici organismi, rendendoli incapaci di tollerare anche minime fluttuazioni della salinità e sono quindi vincolati al loro habitat naturale.
Anche gli organismi marini più primitivi, che si sono evoluti in un ambiente dal quale non si sono poi allontanati, sono per la maggior parte praticamente in equilibrio osmotico con l'acqua che li circonda. Pure i pesci che attraverso milioni di generazioni hanno adattato i loro corpi ai due ambienti differenti, sono rispettivamente incapaci di passare dall'uno all'altro e sono detti stenoalini, cioè adatti ad un ristretto campo di salinità. Tuttavia, i due ambienti acquatici (dolce e salato) si incontrano nelle zone di confine e i loro abitanti hanno sviluppato una certa adattabilità: si parla di pesci salmastri o eurialini che sono tolleranti rispetto ad un ampio intervallo di salinità. Così è per i pesci che vivono negli estuari e popolano un ben determinato territorio: se questo si trova in una zona interessata dalle maree, la salinità del loro habitat varia drasticamente per ben quattro volte al giorno. Le anguille ed ai salmoni, utilizzano le acque dolci per il loro ciclo riproduttivo, alternati da lunghi periodi di permanenza in mare. Gli invertebrati di acqua dolce sono osmoregolatori: infatti i livelli di sali in queste acque sono troppo bassi per garantire le funzioni corporee.
Riassumendo: gli organismi marini si dividono in due categorie: stenoalini (osmoconformi) e eurialini (osmoregolatori). Gli osmoconformi (invertebrati di acqua marina) hanno membrane totalmente permeabili e quindi hanno la stessa concentrazione osmotica all'interno del corpo e nell'ambiente in cui vivono ed al quale sono vincolati; gli osmoregolatori (vertebrati marini, esclusi gli elasmobranchi e i missinoidi) hanno membrane semipermeabili e sono caratterizzati da una concentrazione osmotica propria. Un osmoregolatore teoricamente può vivere in entrambi gli ambienti, sebbene molti altri fattori (pH, temperatura, densità) ne limitano la sopravvivenza.
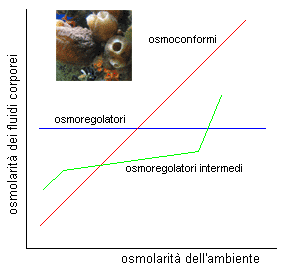 L'osmolarità dell'acqua varia da pochi milliosmoli/litro nel caso delle acque dolci, a 1000 milliosmoli/litro nel caso dell'acqua di mare. Nel grafico a destra, in rosso sono indicati gli organismi osmoconformi, che adattano la loro osmolarità a quella dell'ambiente esterno. In blu gli osmoregolatori, che mantengono costante l'osmolarità interna, al variare di quella dell'ambiente esterno. Infine in verde, gli osmoregolatori intermedi, capaci di adattare la loro osmolarità alle variazioni di osmolarità esterna.
L'osmolarità dell'acqua varia da pochi milliosmoli/litro nel caso delle acque dolci, a 1000 milliosmoli/litro nel caso dell'acqua di mare. Nel grafico a destra, in rosso sono indicati gli organismi osmoconformi, che adattano la loro osmolarità a quella dell'ambiente esterno. In blu gli osmoregolatori, che mantengono costante l'osmolarità interna, al variare di quella dell'ambiente esterno. Infine in verde, gli osmoregolatori intermedi, capaci di adattare la loro osmolarità alle variazioni di osmolarità esterna.
Lo stesso grafico richiede alcuni chiarimenti: i pesci stenoalini possono tollerare solo piccole variazioni della salinità dell'acqua, e quindi la retta in rosso non corrisponde ad un progressivo adattamento dell'organismo, bensì può essere pensata come una retta i cui punti corrispondono a differenti organismi che hanno colonizzato le possibili nicchie ecologiche adattanodosi ad un differente e specifico habitat. La retta in blu, al contrario, si riferisce a qualsiasi organismo che possa adattarsi ad habitat diversi o con condizioni variabili. Il segmento mistilineo in verde si riferisce ad organismi differenti (non uno solo) che possono adattarsi ad un habitat moderatamente variabile.
uccelli e rettili marini bevono acqua di mare, e un'altra importante fonte di sali è rappresentata dal cibo ingerito. I flussi di sodio negli uccelli dipendono dalla loro dimensione e non sembra che ci siano sostanziali differenze tra specie marine e terrestri. Anche il contenuto di acqua (Total Body Water, TBW), è lo stesso e rappresenta in media circa il 60% del peso corporeo, con l'esclusione dei Pinguinidi e dei Procellariformi che hanno un contenuto di acqua leggermente inferiore. I valori ottenuti dalla misurazione di 22 specie marine hanno mostrato che il contenuto varia dal 57% al 69%. Gli uccelli marini eliminano l'eccesso di sali attraverso la ghiandola del sale (presente anche in molti Falconiformi e nel cuculide deserticolo Geococcyx californianus, il famoso roadrunner di Willy coyote). Circa l'80% dei sali ingeriti sono eliminati in questo modo insieme ad un 50% dell'acqua ingerita; in questo modo producono urina ipotonica senza mai disidratarsi.
*modificato e adattato per questo sito da www.biologiamarina.eu
www.acquaportal.it - Paolo Piccinelli, L'acquario di acqua salmastra
| 4 |
Marcello Guidotti, copyright 2003-2004-2007-2008-2010-2011
questa pagina può essere riprodotta su qualsiasi supporto o rivista purché sia citata la fonte e l'indirizzo di questo sito (ai sensi degli artt. 2575 e 2576 cc. Legislazione sul diritto d'autore). Le fotografie sono tratte da siti web e sono, o possono ritenersi, di pubblico dominio purché utilizzate senza fini di lucro. Le immagini di prodotti presenti nel sito hanno unicamente valenza esemplificativa oltre che, eventualmente, illustrare messaggi fuorvianti e non vi è alcun richiamo diretto o indiretto alla loro qualità e/o efficacia il cui controllo è affidato alle autorità regolamentatorie.