la teoria DLVO
Una teoria quantitativa per le particelle disperse è stata elaborata indipendentemente da Derjaguin e Landau (1941) nell'allora URSS e da Verwey e Overbeek (1948) in Olanda. Detta teoria, nota come DLVO (dalle iniziali dei suoi teorizzatori) prevede e spiega molti risultati ottenibili sperimentalmente, ma una sua elaborazione per ottenere un maggior accordo con i dati sperimentali è ancóra oggetto di studio.
interazioni di van der Waals e London
E' noto che le forze agenti fra cariche elettriche puntiformi fanno sì che due cariche elettriche si respingano se sono di segno uguale, o si attraggano se di segno opposto. In entrambi i casi le forze attrattive e repulsive seguono la legge di Coulomb.
In assenza di cariche nette, considerando il comportamento delle molecole, si trova che la forza agente tra due o più molecole non ionizzate, è data dalla sovrapposizione di tre tipi di forze, che non seguono la legge di Coulomb:
- Legame idrogeno: è un tipo molto forte di interazione dipolo-dipolo e si instaura quando un atomo di idrogeno è legato ad un atomo molto elettronegativo: si sviluppa una frazione di carica positiva sull'idrogeno che diviene altamente polarizzato (+) ed una frazione negativa sull'altro atomo (-). Quando sull'atomo elettronegativo è presente almeno una coppia di elettroni di non legame, allorché una seconda molecola si avvicina, le due molecole si orientano in modo da esporre la propria coppia di elettroni liberi verso l'idrogeno: in questo modo si genera una grande forza di attrazione elettrostatica [fig.1]. Tipici atomi molto elettronegativi sono Ossigeno, Cloro, Azoto, Bromo. Il legame idrogeno è la più forte delle interazioni tra molecole in termini di energia; l'intensità della forza dipende dall'atomo legato all'idrogeno e dalla coppia di elettroni libera.
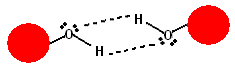
fig.1 - Interazione legame idrogeno tra due molecole (sfere) tramite gruppi ossidrilici (O-H)
- Interazione dipolo-dipolo: quando due atomi generici differenti (A, B) sono legati chimicamente, a causa della loro differente capacità di attrarre gli elettroni, si instaura tra loro una differenza di posizione tra il baricentro delle cariche positive (+) e negative (-) generando un dipolo elettrico e la molecola si dice polare [Fig.2]. Due dipoli elettrici vicini tendono ad orientarsi in modo che il baricentro del primo dipolo (+) sia vicino a quello (-) del secondo dipolo e per conseguenza si attraggono elettrostaticamente. L'effetto è simile al precedente, in quanto il legame idrogeno è un particolare tipo di interazione dipolo-dipolo; però, in questo caso, l'attrazione non è potenziata dalla presenza di elettroni liberi. Dopo il legame idrogeno, le interazioni dipolo sono le forze di attrazione intermolecolare maggiori. La loro intensità dipende dall'intensità del dipolo elettrico.
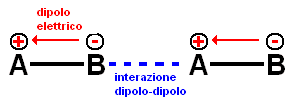
fig.2 - due molecole dotate di dipolo interagiscono
- Forze di van der Waals: sono forze di energia inferiore rispetto alle precedenti: si dividono in:
- dipolo-dipolo indotto: quando una molecola polare si avvicina ad una non polare induce in quest'ultima un dipolo eletrico di minore intensità che perdura fintanto che le due molecole restano vicine. Si genera così attrazione come per il dipolo-dipolo [Fig.3]. L'intensità è proporzionale al dipolo che induce polarizzazione e dalla polarizzabilità della seconda molecola, grandezza che a sua volta cresce con la superfice della molecola.
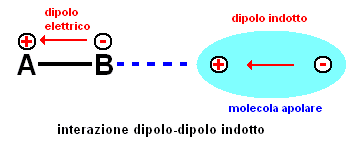
fig.3 -interazione forze di van der Waals
- dipolo istantaneo-dipolo indotto: sono dette forze di dispersione di London, dal nome del fisico che le ha studiate. Gli elettroni che si muovono continuamente attorno ad un nucleo creano piccolissimi dipoli istantanei che inducono a loro volta dipoli istantanei su molecole vicine. Queste forze sono debolissime, ma la loro somma genera una risultante che tiene assieme molecole non polari. Sono proporzionali alla superfice delle molecole interagenti.
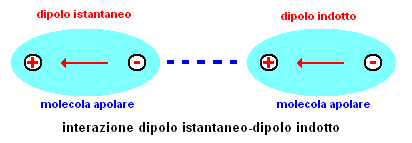
fig.4 - interazione forze di London
Le forze di van der Waals si manifestano anche fra molecole non polari. La fig. 5 fornisce una spiegazione intuitiva del fenomeno.
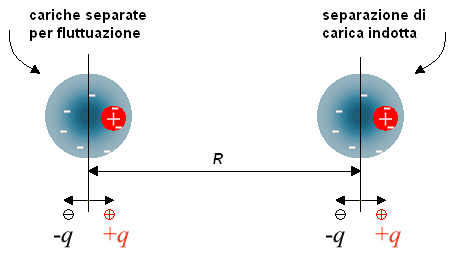
fig.5 - interazione fra molecole apolari
Nel caso di due molecole separate da una certa distanza, una debole attrazione è dovuta alla struttura della legge di Coulomb: il movimento interno della nuvola elettronica e del nucleo può indurre attrazione. Questa forza è chiamata forza di van der Waals.
rappresentazione grafica della teoria DLVO
La distribuzione delle cariche sulla superficie delle particelle è di importanza decisiva per la stabilità dei sistemi dispersi; queste cariche si possono produrre in conseguenza di:
- ionizzazione delle molecole disperse;
- adsorbimento di ioni presenti nel solvente;
- attrito.
Le cariche elettrostatiche superficiali determinano repulsione tra le particelle con cariche dello stesso segno, opponendosi così alle forze di attrazione di London e van der Waals. Le energie potenziali elettrostatiche associate alle forze repulsive ed attrattive di London e van der Waals, sono rappresentate da formule piuttosto complesse ma essenzialmente legate alle distribuzioni di carica ed alla distanza, variabile esponenzialmente. E' proprio questo andamento fortemente esponenziale a far sì che queste forze siano rilevanti solo a distanze molecolari: con l'aumento delle reciproche distanze esse diventano rapidamente trascurabili rispetto alle forze elettrostatiche coulombiane fra cariche puntiformi. Poiché le forze attrattive e quelle repulsive diminuiscono con andamento esponenziale diverso, è facile giustificare l'andamento della forza risultante fra attrazioni e repulsioni e quindi dell'energia associata ad un sistema di particelle.
 Come è visualizzato dal grafico qualitativo a destra, l'energia potenziale elettrostatica repulsiva, Erep, di un sistema costituito da due particelle, aumenta via via che queste si avvicinano reciprocamente; anche l'energia potenziale elettrostatica attrattiva, Eatt, aumenta, ma molto più rapidamente: all'interno del dominio in cui si manifesta l'azione di queste forze deboli, le forze di attrazione sono prevalenti su quelle repulsive se le particelle sono quasi a contatto; però, la situazione si inverte appena le particelle si allontanano e per conseguenza il sistema perde di stabilità.
Come è visualizzato dal grafico qualitativo a destra, l'energia potenziale elettrostatica repulsiva, Erep, di un sistema costituito da due particelle, aumenta via via che queste si avvicinano reciprocamente; anche l'energia potenziale elettrostatica attrattiva, Eatt, aumenta, ma molto più rapidamente: all'interno del dominio in cui si manifesta l'azione di queste forze deboli, le forze di attrazione sono prevalenti su quelle repulsive se le particelle sono quasi a contatto; però, la situazione si inverte appena le particelle si allontanano e per conseguenza il sistema perde di stabilità.

Mentre le forze di tipo coulombiano hanno la stessa formulazione matematica sia per cariche omonime che discordi, le forze di London e van der Waals presentano andamenti diversi per la repulsione e per l'attrazione.
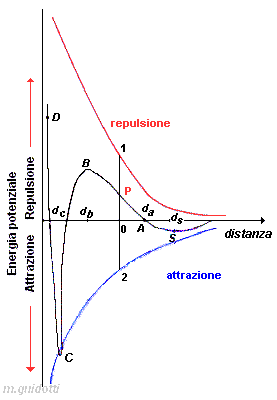
Sommando algebricamente le equazioni per le due differenti energie si ottiene l'energia potenzale elettrostatica totale per un sistema costituito da due particelle. Ciò equivale a sommare graficamente punto dopo punto le ordinate delle due curve, ottenendo la curva risultante DCBA (in nero). Per esempio, il punto P sulla curva risultante è ottenuto sommando punto a punto le ordinate dei grafici corrispondenti alle energie repulsive date dal segmento + 01 , ed attrattive date dal segmento - 02; quindi P = 01 - 02.
Per comprendere il significato della teoria DLVO - applicabile quando le forze in gioco sono di intensità confrontabile con quelle di van der Walls - è necessario fissare l'attenzione esclusivamente sulla curva risultante, piuttosto che considerare le singole energie attrattive e repulsive.
Il grafico qualitativo in alto, mostra due particelle identiche con una piccola carica uguale, disperse in un liquido in cui sono insolubili. Queste particelle vanno incontro ad una collisione a causa del moto browniano, di correnti di convezione, sedimentazione, oppure perché la dispersione è agitata.
In particolare, allorché due particelle si avvicinano l'una all'altra, le nuvole di controioni che le circondano iniziano a compenetrarsi o sovrapporsi al punto A corrispondente alla distanza da. Questo produce una netta energia repulsiva (positiva) in quanto il lavoro necessario per distorcere il doppio strato diffuso e per espellere molecole di acqua e controioni, aumenta all'avvicinarsi delle particelle. Se le particelle continuano ad avvicinarsi l'una all'altra, si raggiunge il massimo positivo (punto B). Se l'altezza della barriera di energia potenziale, B, è maggiore dell'energia cinetica delle particelle che si avvicinano, esse non supereranno la distanza db, ma si allontaneranno l'una dell'altra, rendendo la dispersione stabile. D'altra parte, se le energie cinetiche superano la barriera di energia potenziale, B, le particelle continueranno ad avvicinarsi oltre db, dove le forze di van der Waals incrementano molto più significativamente rispetto alla repulsione elettrostatica. Di conseguenza, l'energia potenziale d'interazione tende a zero e quando diventa negativa, fa sì che le particelle si riuniscano strettamente insieme.
Quando le particelle raggiungono la distanza dc, si raggiunge un minimo profondo nell'energia potenziale che corrisponde ad una struttura molto stabile nella quale le particelle aderiscono tra loro con la maggior stabilità possibile; d'altra parte, questa situazione è improbabile in quanto difficilmente le particelle disperse posseggono abbastanza energia cinetica per superare la barriera di energia potenziale B.
Qualsiasi ulteriore avvicinamento di due particelle che riduce la distanza dP comporta un rapido aumento dell'energia potenziale lungo PD in quanto le particelle solide dovrebbero compenetrarsi reciprocamente in modo da sovrapporre i loro orbitali.
un vaso rotto...
Se non è un vaso, è qualcosa d'altro... perché certamente tutti abbiamo fatto l'esperienza del danneggiamento di un oggetto al quale tenevamo. A volte siamo risuciti a ripararlo (o a farlo riparare) con risultati più o meno soddisfacenti. Per ripararlo, quasi certamente è stato utilizzato un adesivo. E perché mai? Dopotutto erano le forze intermolecolari a tenere insieme il nostro vaso. E allora perché non è sufficiente accostare fra loro i pezzi (anche nel caso più favorevole che siano solo due) così accuratamente da rendere impercettibile la riparazione dal momento che anche in questo caso sono in gioco sempre le stesse forze intermolecolari?
Colle, paste, adesivi aiutano certamente la riparazione, e per farlo devono avere certe caratteristiche: devono essere appiccicosi, più o meno fluidi. Tuttavia, certi adesivi sono adatti per alcuni materiali e non per altri e ci sono materiali che, qualunque sia l'adesivo usato, si possono far aderire (per es. il teflon®), unicamente ricorrendo a tecnologie speciali.
Gli adesivi devono le loro proprietà all'attrazione molecolare fra le superfici dell'adesivo e del materiale al quale è applicato. In realtà, molti materiali potrebbero essere utilizzati come adesivi, sebbene siano poco efficaci. Per esempio, l'acqua allo stato liquido potrebbe servire ad incollare le cose se non fosse per la sua limitatissima resistenza agli sforzi di taglio.
La maggior parte degli adesivi sono fluidi, almeno inizialmente, in modo da garantire un contatto stretto tra l'adesivo e i materiali (che possono essere diversi) da incollare. Infatti, per permettere alle due superfici di aderire, la loro reciproca distanza deve essere a distanze dell'ordine di 10-10 m, la dimensione delle molecole. Però, la maggior parte delle superfici solide sono troppo ruvide (o irregolari, in termini molecolari) e permettono un reciproco stretto contatto solo per una piccola percentuale della loro superficie. Una colla fluida può scorrere fra le irregolarità superficiali favorendo un contatto stretto.
Un'altra ragione per la quale la maggior parte delle superfici, come i bordi dei pezzi in cui si è rotto il nostro vaso, non aderiscono per contatto diretto è che essi non sono puliti. Se entrambi fossero puliti e lisci, le superfici potrebbero aderire spontaneamente. Questa aderenza spontanea la si può osservare in strati di mica separati da poco. Ricongiungendo le loro superfici pochi secondi dopo la loro separazione, gli strati aderiscono. D'altra parte, se si attende una mezz'ora, o anche meno, l'aria e il pulviscolo contamineranno le superfici esposte impedendo l'adesione definitiva per contatto.
applicazioni in natura delle forze di van der Waals
E' esperienza comune che mosche, ragni, lucertole ed altre creature hanno la sorprendente capacità di posarsi e muoversi ovunque, anche su superfici lisce come specchi. L'evoluzione ha dotato queste forme di vita, per le quali l'adesione è ora essenziale per la sopravvivenza, di strumenti dalle forme più varie per sfruttare le deboli forze di van der Waals in modo da consentire loro di vivere comodamente anche sui soffitti delle nostra ebitazioni.
L'attenzione dei ricercatori si è concentrata su animali di dimensioni più significative di quelle degli insetti. Per esempio, il geco, si arrampica a secco, senza l'intervento di secrezioni adesive. Il geco sfrutta le forze di van der Waals che si instaurano tra due superfici a contatto. In particolare, l'utilizzo di queste forze è reso possibile dal fatto che le estremità delle sue zampe sono caratterizzate da milioni di peli che moltiplicando altrettante volte le deboli forze elettromagnetiche, permettono di ottenere una coesione che gli consente di sostenere il proprio peso.
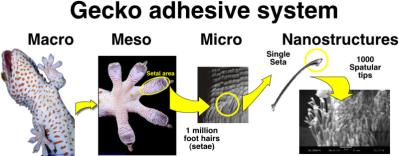
sistema di adesione del geco (fonte: robotics.eecs/berkeley.edu)
Per ricondurre il meccanismo di azione delle forze di van der Waals ad un'immagine familiare, si può pensare al velcro: i microscopici peli (dimensioni circa 0,008 mm; cioé 1/10 di un capello umano) si insinuano nella superficie apparentemente liscia con la quale vengono a contatto, cosa impossibile per strutture non molecolari.
Gli studi hanno dimostrato che all'aumentare del peso dello "scalatore", diminuisce la dimensione delle superfici di contatto e aumenta il loro numero. La minor forza di ogni contatto è quindi compensata dal maggior numero di superfici e dunque il sistema adesivo nell'insieme si rafforza.
In natura e nella tecnologia, l'adesione ottimale può essere ottenuta dalla combinazione di ottimizzazione della forma e riduzione delle dimensioni. La forma diviene meno importante con il diminuire delle dimensioni. Ad ampie dimensioni di contatto, un'adesione ottimale potrebbe ancora essere ottenuta con una forma realizzata con precisione sufficientemente alta. Da un punto di vista pratico, è necessario ridurre le dimensioni di contatto per ottenere un'efficace adesione. Questi princìpi potrebbero rivestire grande interesse nella progettazione di materiali artificiali.
Foto a destra: struttura fibrillare dei filamenti adesivi alle estremità delle zampe del coleottero, della mosca, del ragno, del geco. La densità superficiale dei peli aumenta con il peso dell'animale ed il geco presenta la maggior densità fra tutte le specie.
foto: Max Planck Institute for Metals Research/Gorb
 La foto a sx mostra un uomo ragno giocattolo aggrappato ad una superficie di vetro orizzontale. Il giocattolo (15 cm di altezza; peso 40 g) viene coperto con il nastro in microfibra imitante il gecko, che fornisce approssimatiamente una superficie di contatto di 0.5 cm2 con il vetro e una capacità di carico maggiore di 100 g . Si noti che il giocattolo è stato già riattaccato più volte su varie superici prima che questa foto fosse scattata.
La foto a sx mostra un uomo ragno giocattolo aggrappato ad una superficie di vetro orizzontale. Il giocattolo (15 cm di altezza; peso 40 g) viene coperto con il nastro in microfibra imitante il gecko, che fornisce approssimatiamente una superficie di contatto di 0.5 cm2 con il vetro e una capacità di carico maggiore di 100 g . Si noti che il giocattolo è stato già riattaccato più volte su varie superici prima che questa foto fosse scattata.
H. Gao, H. Yao - Shape insensitive optimal adhesion of nanoscale fibrillar structures;
Proceedings of the National Academy of Sciences of the USA, 2004, Vol. 101, no. 21, pp. 7851-7856, Early Edition, published May 17, 2004, 10.1073/pnas.0400757101
Marcello Guidotti, copyright 2004-2008-2009-2013
questa pagina può essere riprodotta su qualsiasi supporto o rivista purché sia citata la fonte e l'indirizzo di questo sito (ai sensi degli artt. 2575 e 2576 cc. Legislazione sul diritto d'autore). Le fotografie sono tratte da siti web e sono, o possono ritenersi, di pubblico dominio purché utilizzate senza fini di lucro. Le immagini di prodotti presenti nel sito hanno unicamente valenza esemplificativa oltre che, eventualmente, illustrare messaggi fuorvianti e non vi è alcun richiamo diretto o indiretto alla loro qualità e/o efficacia il cui controllo è affidato alle autorità regolamentatorie.
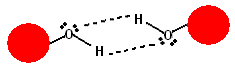




 Come è visualizzato dal grafico qualitativo a destra, l'energia potenziale elettrostatica repulsiva, Erep, di un sistema costituito da due particelle, aumenta via via che queste si avvicinano reciprocamente; anche l'energia potenziale elettrostatica attrattiva, Eatt, aumenta, ma molto più rapidamente: all'interno del dominio in cui si manifesta l'azione di queste forze deboli, le forze di attrazione sono prevalenti su quelle repulsive se le particelle sono quasi a contatto; però, la situazione si inverte appena le particelle si allontanano e per conseguenza il sistema perde di stabilità.
Come è visualizzato dal grafico qualitativo a destra, l'energia potenziale elettrostatica repulsiva, Erep, di un sistema costituito da due particelle, aumenta via via che queste si avvicinano reciprocamente; anche l'energia potenziale elettrostatica attrattiva, Eatt, aumenta, ma molto più rapidamente: all'interno del dominio in cui si manifesta l'azione di queste forze deboli, le forze di attrazione sono prevalenti su quelle repulsive se le particelle sono quasi a contatto; però, la situazione si inverte appena le particelle si allontanano e per conseguenza il sistema perde di stabilità.



 La foto a sx mostra un uomo ragno giocattolo aggrappato ad una superficie di vetro orizzontale. Il giocattolo (15 cm di altezza; peso 40 g) viene coperto con il nastro in microfibra imitante il gecko, che fornisce approssimatiamente una superficie di contatto di 0.5 cm2 con il vetro e una capacità di carico maggiore di 100 g . Si noti che il giocattolo è stato già riattaccato più volte su varie superici prima che questa foto fosse scattata.
La foto a sx mostra un uomo ragno giocattolo aggrappato ad una superficie di vetro orizzontale. Il giocattolo (15 cm di altezza; peso 40 g) viene coperto con il nastro in microfibra imitante il gecko, che fornisce approssimatiamente una superficie di contatto di 0.5 cm2 con il vetro e una capacità di carico maggiore di 100 g . Si noti che il giocattolo è stato già riattaccato più volte su varie superici prima che questa foto fosse scattata.