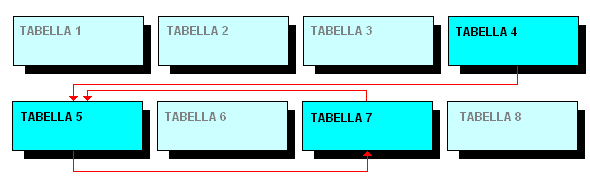
 come si vede dallo schema, la tabella 4 può rimandare alla tabella 5 e questa alla tabella 7. La tabella 7, a sua volta, può rimandare alla tabella 5. (Cliccando sui riquadri si accede alle tabelle 1, 2, 3, 6, 9). |
 come si vede dallo schema, la tabella 4 può rimandare alla tabella 5 e questa alla tabella 7. La tabella 7, a sua volta, può rimandare alla tabella 5. (Cliccando sui riquadri si accede alle tabelle 1, 2, 3, 6, 9). |
Integrazioni e correzioni alle tabelle della XII edizione della Farmacopea Ufficiale della Repubblica Italiana coma da Decreto del Ministero della salute 26 febbraio 2010 in gazzetta Ufficiale n. 77 del 2 aprile 2010
1) Preparazioni di barbiturici in associazione ad altri princìpi attivi, ad eccezione di quelle preparazioni ad azione antalgica che contengono quantità di barbiturici, per dose unitaria, tale da aver giustificato la loro esenzione dall'obbligo di ricetta in sede di AIC (Autorizzazione all'Immissione in Commercio ) delle preparazioni stesse come medicinale industriale.
2) Tranquillanti, ansiolitici, e derivati pirazolopirimidinici, neurolettici, salvo quelli previsti nella Tabella 5. [questo dà ragione delle frecce colorate in rosso da tab. 4 a tab. 5 - NdR]
3) Antidepressivi salvo quelli previsti nella Tabella 5.
4) Antiepilettici non barbiturici.
5)Preparazioni di ipnotici non barbiturici in associazione ad altri princìpi attivi, ad eccezione di quelle preparazioni ad indicazione antalgica che contengono quantità di ipnotico non barbiturico, per dose unitaria, tale da aver giustificato la loro esenzione dall'obbligo di ricetta in sede di AIC delle preparazioni stesse come medicinale industriale.
6) Antispastici, anticolinergici, miorilassanti ad azione centrale e procinetici ad eccezione del punto 12) della Tabella 5.
7) Antiulcera peptica (antagonisti dei recettori H2, inibitori della pompa acida, ecc.)
8) Cardiovascolari (cardiotonici, antianginosi, anti-aritmici, betabloccanti, ecc.).
9) Diuretici, antipertensivi, preparazioni per applicazione cutanea contenenti minoxidil in concentrazione superiore al 2 per cento.
10) vasoattivi.
11) Uricosurici e antigottosi.
12) Antimicrobici (sulfamidici, antibiotici, antifungini), antivirali.
13) Ormoni sintetici ed estrattivi, medicinali ad azione ormonica.
14) Tutti i medicinali contenenti estrogeni, progestinici, soli ed associati, aventi come esclusiva indicazione la prevenzione del concepimento.
15) Antiparkinsoniani.
16) Anticoagulanti ed emocoagulanti, escluse le preparazioni per applicazione cutanea.
17) Antistaminici escluse le preparazioni per applicazione cutanea.
18) Ipoglicemizzanti e iperglicemizzanti
19) Analgesici non stupefacenti, antinfiammatori, antireumatici, ad eccezione delle preparazioni previste ai punti 1) e 5) della presente tabella e di quelle per applicazione cutanea.
20) Ipolipidemizzanti, ipocolesterolemizzanti
21) Medicinali a base di vitamine, quando siano presentati in dosi tali da poter determinare danni da ipervitaminosi
22) Preparati per la tosse ad azione centrale, salvo quanto previsto dal punto 30) della presente tabella
23) Preparazioni per uso diverso da quello iniettabile, contenenti destropropoxifene in associazione con altri principi attivi.
24) Antiemetici ed antinausea, esclusi i preparati a base di dimenidrinato.
25) Antidoti ad azione specifica, ad eccezione del naloxone iniettabile
26) Vaccini semplici o misti, preventivi e curativi, escluso il punto 12) della Tabella 5.
27) Sieri preventivi e curativi.
28) Antiprotozoari e antielmintici.
29) Tutti i medicinali per uso parenterale
(intramuscolare, endovenoso, ecc.), ad eccezione dell'acqua sterile per preparazioni iniettabili e di sodio cloruro 0,9 per cento (soluzione fisiologica).
30) Composizioni per somministrazioni ad uso diverso da quello parenterale contenenti acetildiidrocodeina, codeina, diidrocodeina, etilmorfina, folcodina, nicocodina, nocodicodina, norcodeina e loro sali in quantità espressa in base anidra, non superiore 10 mg per unità di somministrazione o in quantità percentuale, espressa in base anidra, inferiore all'1 per cento p/V (peso/Volume) della soluzione multidose. Composizioni per somministrazione rettale contenenti acetildiidrocodeina, codeina, diidrocodeina, etilmorfina, folcodina, nicocodina, nicodicodina, norcodeina e loro sali in base anidra, non superiore a 20 mg per unità di somministrazione.
30)Composizioni per somministrazioni ad uso diverso da quello parenterale, contenenti acetildiidrocodeina, codeina, diidrocodeina, etilmorfina, folcodina, nicocodina, nicodicodina, norcodeina e loro sali in quantità, espressa in base anidra, superiore a 10 mg per unità di somministrazione o in quantità percentuale, espressa in base anidra, inferiore all'1% p/V (peso/Volume) della soluzione multidose; Composizioni per somministrazione rettale contenenti acetildiidrocodeina, codeina, diidrocodeina, etilmorfina, folcodina, nicocodina, nicodicodina, norcodeina e loro sali in quantità, espressa in base anidra, superiore a 20 mg fino a 100 mg per unità di somministrazione.
31)Immunostimolanti
32)I medicinali veterinari prescritti ad animali da compagnia e per essi indicati in modo esclusivo, ad eccezione di quelli riportati all'ultimo periodo del punto 18) della tabella n. 5. Il Ministero della salute può espressamente autorizzare alcuni chemioterapici, antibiotici ed antiparassitari orali qualora siano destinati al trattamento di allevamenti a carattere familiare che producono per autoconsumo.
33)Medicinali usati nella disfunzione dell'erezione.
34)Tutti i nuovi prodotti introdoti in terapia fatta salva ogni determinazione del Ministero della salute.
Note:
E’ comunque subordinata a presentazione obbligatoria della ricetta medica la vendita dei medicinali (con AIC - NdR) per i quali il Ministero della Salute faccia obbligo di riportare sulle etichette la scritta "Da vendersi dietro presentazione di ricetta medica".
Il Ministro della Salute potrà ammettere alla vendita senza ricetta medica preparazioni medicinali appartenenti alle categorie elencate, qualora per dose unitaria, quantità contenuta nella singola confezione, natura del medicamento e modalità d'uso, non risultino pericolose (farmaci O.T.C. - NdR).
I preparati magistrali a base di princìpi attivi contenuti in medicinali di origine industriale e soggetti a ricetta limitativa secondo gli artt. 92, 93 e 94 del Decreto Legislativo 24 aprile 2006, n. 219) e successive modificazioni possono essere allestiti solo alle condizioni previste in sede di AIC per i medicinali industriali corrispondenti.
 La ripetibilità della vendita dei medicinali, soggetti all'obbligo di ricetta medica, è consentita, salvo diversa indicazione del medico, per un periodo non superiore a sei mesi a partire dalla data di compilazione della ricetta e comunque per non più di dieci volte, ad esclusione dei medicinali contenenti sostanze stupefacenti e psicotrope, di cui alla tab. II sez. E della tabella n. 7, per i quali la ripetibilità della vendita è consentita per un periodo non superiore a trenta giorni e complessivamente per non più di tre volte. L'indicazione da parte del medico di un numero di confezioni superiore all'unità esclude la ripetibilità della ricetta (Per es., se il medico prescrive due confezioni di ansiolitico, la ricetta è limitata alla due confezioni: non potranno essere dispensate 2 confezioni per cinque volte!).
La ripetibilità della vendita dei medicinali, soggetti all'obbligo di ricetta medica, è consentita, salvo diversa indicazione del medico, per un periodo non superiore a sei mesi a partire dalla data di compilazione della ricetta e comunque per non più di dieci volte, ad esclusione dei medicinali contenenti sostanze stupefacenti e psicotrope, di cui alla tab. II sez. E della tabella n. 7, per i quali la ripetibilità della vendita è consentita per un periodo non superiore a trenta giorni e complessivamente per non più di tre volte. L'indicazione da parte del medico di un numero di confezioni superiore all'unità esclude la ripetibilità della ricetta (Per es., se il medico prescrive due confezioni di ansiolitico, la ricetta è limitata alla due confezioni: non potranno essere dispensate 2 confezioni per cinque volte!).
Il farmacista deve conservare per sei mesi copia della ricetta quando prepara e dispensa un preparato magistrale o officinale.
Note:
Per l'acquisto, la detenzione, la vendita e le operazioni di documentazione delle sostanze stupefacenti e psicotrope e loro preparazioni indicate nella Tabella II, sez. A della Tabella n. 7 approvata con decreto ministeriale, in applicazione degli articoli 13 e 14 del D.P.R. 9 ottobre 1990, n. 309 e successive modifiche, vanno rispettate le disposizioni della legge medesima e delle successive integrazioni e modifiche introdotte con la Legge 8 febbraio 2001, n. 12
E' comunque subordinata a presentazione obbligatoria della ricetta medica da rinnovare volta per volta, da ritirare da parte del farmacista, la vendita dei medicinali soggetti ad autorizzazione all'immissione in commercio per i quali il Ministero della salute faccia obbligo di riportare sulle etichette la dicitura "Da vendersi dietro presentazione di ricetta medica utilizzabile una sola volta" o dizione analoga".
Con decreto del Ministro della salute possono essere stabilite, nel rispetto delle direttive e raccomandazioni della Comunità economica europea, condizioni e prescrizioni di carattere generale relative a tutti i medicinali o a particolari gruppi di essi, ivi comprese disposizioni sull'etichettatura e sul confezionamento dei medicinali e sulle modalità di prescrizione e di impiego.
Il Ministro della salute può vietare l'utilizzazione di medicinali, anche preparati in farmacia ritenuti pericolosi per la salute pubblica.
La ricetta medica da rinnovare volta per volta (non ripetibile), relativa ai medicinali soggetti ad autorizzazione all'immissione in commercio ai sensi dell'art. 89 del Decreto Legislativo 24 aprile 2006, n. 219 ha validità limitata a trenta giorni e deve essere ritirata dal farmacista che è tenuto a conservarla per sei mesi e quindi a distruggerla per evitare l'accesso di terzi ai dati in essa contenuti ai sensi del Decreto Legislativo 30 luglio 1999, n. 282, qualora non la consegni all'Autorità competente per il rimborso del prezzo a carico del Servizio Sanitario Nazionale; la ricetta priva del nome e cognome del paziente (o delle sole iniziali, nei casi in cui disposizioni di carattere speciale esigano la riservatezza dei trattamenti), della data e della firma del medico non ha validità. In ogni altro caso, la ricetta non ripetibile ha validità limitata a trenta giorni.
Il farmacista deve conservare per almeno sei mesi le ricette non ripetibili relative ai preparati magistrali e officinali. Nel caso di ricette contenenti sostanze soggette alla Legge 14-12-2000, n. 376, i sei mesi decorrono a partire dal 31 gennaio dell'anno in cui viene effettuata la trasmissione dei dati al Ministero della salute.
Per la documentazione delle ricette veterinarie il farmacista è tenuto, in base al nuovo codice comunitario per i prodotti veterinari, a conservare per cinque anni la copia della ricetta medica veterinaria in triplice copia la cui validità massima è di dieci giorni lavorativi dalla data di emissione, di cui al punto 17) della presente tabella e per sei mesi le ricette non ripetibili di cui ai punti 18) e 19) della presente tabella.
a) nella tabella I sono indicati:
1) l'oppio e i materiali da cui possono essere ottenute le sostanze oppiacee naturali, estraibili dal papavero sonnifero; gli alcaloidi ad azione narcotico-analgesica da esso estraibili; le sostanze ottenute per trasformazione chimica di quelle prima indicate; le sostanze ottenibili per sintesi che siano riconducibili, per struttura chimica o per effetti, a quelle oppiacee precedentemente indicate; eventuali intermedi per la loro sintesi;
2) le foglie di coca e gli alcaloidi ad azione eccitante sul sistema nervoso centrale da queste estraibili; le sostanze ad azione analoga ottenute per trasformazione chimica degli alcaloidi sopra indicati oppure per sintesi;
3) le sostanze di tipo amfetaminico ad azione eccitante sul sistema nervoso centrale;
4) ogni altra sostanza che produca effetti sul sistema nervoso centrale ed abbia capacità di determinare dipendenza fisica o psichica dello stesso ordine o di ordine superiore a quelle precedentemente indicate;
5) gli indolici, siano essi derivati triptaminici che lisergici, e i derivati feniletilamminici, che abbiano effetti allucinogeni o che possano provocare distorsioni sensoriali;
6) la cannabis indica, i prodotti da essa ottenuti; i tetraidrocannabinoli, i loro analoghi naturali, le sostanze ottenute per sintesi o semisintesi che siano ad essi riconducibili per struttura chimica o per effetto farmaco-tossicologico;
7) ogni altra pianta i cui principi attivi possono provocare allucinazioni o gravi distorsioni sensoriali e tutte le sostanze ottenute per estrazione o per sintesi chimica che provocano la stessa tipologia di effetti a carico del sistema nervoso centrale;

Il farmacista allestisce e dispensa preparazioni magistrali a base dei farmaci compresi nella presente tabella, da soli o in associazione con farmaci non stupefacenti, dietro presentazione di ricetta autocopiante, ad esclusione di quelle che, per la loro composizione
quali-quantitativa, rientrano nella tabella II, sezione D o E.
b) nella sezione A (ricetta medica a ricalco, RMR) della tabella II sono indicati:
1) i medicinali contenenti le sostanze analgesiche oppiacee naturali, di semisintesi e di sintesi;
2) i medicinali di cui all'allegato III-bis al presente testo unico (indicati con **);
3) i medicinali contenenti sostanze di corrente impiego terapeutico per le quali sono stati accertati concreti pericoli di induzione di grave dipendenza fisica o psichica;
4) i barbiturici che hanno notevole capacità di indurre dipendenza fisica o psichica o entrambe, nonché altre sostanze ad effetto ipnotico-sedativo ad essi assimilabili ed i medicinali che li contengono;
tab. II sez. A
sostanze e composizioni medicinali
Acetildiidrocodeina
Alfentanil
Amobarbital
Buprenorfina **
Ciclobarbital
Codeina**
..........

Il farmacista allestisce e dispensa preparazioni magistrali a base dei farmaci compresi nella presente tabella, da soli o in associazione con altri farmaci non stupefacenti, dietro presentazione di ricetta da rinnovarsi volta per volta.

A differenza di quanto previsto dalla tab. II sez A, per cui i farmaci in essa compresi (se la loro composizione quali-quantitativa lo consente) possono rientrare nelle sezioni D o E, questa possibilità per i farmaci compresi nella sez. B, è riservata ai soli medicinali in sede di concessione AIC.
c) nella sezione B (ricetta non ripetibile, RNR) della tabella II sono
indicati:
1) i medicinali che contengono sostanze di corrente impiego terapeutico per le quali sono stati accertati concreti pericoli di induzione di dipendenza fisica o psichica di intensità e gravità minori di quelli prodotti dai medicinali elencati nella sezione A;
2) i barbiturici ad azione antiepilettica e i barbiturici con breve durata d'azione;
3) le benzodiazepine, i derivati pirazolopirimidinici ed i loro analoghi ad azione ansiolitica o psicostimolante che possono dar luogo al pericolo di abuso e generare farmacodipendenza;
tab. II sez. B
sostanze medicinali
Acido gamma-idrossibutirrico (GHB)
Acido
5-etil-5-crotilbarbiturico
Alazepam
Allobarbital
Alossazolam
Alprazolam
d) nella sezione C della tabella II sono indicati:
1) le composizioni medicinali contenenti le sostanze elencate nella tabella II, sezione B, da sole o in associazione con altri principi attivi, per i quali sono stati accertati concreti pericoli di induzione di dipendenza fisica o psichica;
tab. II sez. C
composizioni medicinali contenenti
Barbexaclone
Destropropossifene
Fenobarbital
Pentazocina
e) nella sezione D della tabella II sono indicati:
1) le composizioni medicinali contenenti le sostanze elencate nella tabella II, sezioni A o B, da sole o in associazione con altri principi attivi quando per la loro composizione qualitativa e quantitativa e per le modalità del loro uso, presentano rischi di abuso o farmacodipendenza di grado inferiore a quello delle composizioni medicinali comprese nella tabella II, sezioni A e C, e pertanto non sono assoggettate alla disciplina delle sostanze che entrano a far parte della loro composizione;
2) le composizioni medicinali ad uso parenterale a base di benzodiazepine;
3) le composizioni medicinali per uso diverso da quello iniettabile, le quali, in associazione con altri principi attivi non stupefacenti contengono alcaloidi totali dell'oppio con equivalente ponderale in morfina non superiore allo 0,05 per cento in peso espresso come base anidra; le suddette composizioni medicinali devono essere tali da impedire praticamente il recupero dello stupefacente con facili ed estemporanei procedimenti estrattivi;
tab. II sez. D
Ricetta da rinnovarsi volta per volta, RNR.
I medicinali contrassegnati con ** sono inclusi nell'allegato III bis.
Con Decreto 31 marzo 2010 MinSalute in G.U. n. 78 del 3-4-2010, sono state aggiornate le tabelle contenenti l'indicazione delle sostanze stupefacenti e psicotrope e relative composizioni medicinali, di cui al decreto del Presidente della Repubblica del 9 ottobre 1990 n. 309 e successive modificazioni ed integrazioni, con sostituzione della tabella II, sezione D del Testo Unico.
 La semplificazione operata per favorire la terapie del dolore, comporta alcuni obblighi per il farmacista: "Entro la fine di ciascun mese i farmacisti inviano all'Ordine provinciale competente per territorio una comunicazione riassuntiva del numero delle confezioni dispensate nel mese precedente, distinte per forma farmaceutica e dosaggio, limitatamente alle ricette, diverse da quella di cui al decreto Ministro della salute del 10 marzo 2006 (Ricettario in triplice copia a ricalco - NdR) o da quella del Servizio sanitario nazionale disciplinata dal decreto del Ministro dell'economia e delle finanze del 17 marzo 2008, effettivamente spedite e contenenti la prescrizione delle seguenti composizioni medicinali:"
La semplificazione operata per favorire la terapie del dolore, comporta alcuni obblighi per il farmacista: "Entro la fine di ciascun mese i farmacisti inviano all'Ordine provinciale competente per territorio una comunicazione riassuntiva del numero delle confezioni dispensate nel mese precedente, distinte per forma farmaceutica e dosaggio, limitatamente alle ricette, diverse da quella di cui al decreto Ministro della salute del 10 marzo 2006 (Ricettario in triplice copia a ricalco - NdR) o da quella del Servizio sanitario nazionale disciplinata dal decreto del Ministro dell'economia e delle finanze del 17 marzo 2008, effettivamente spedite e contenenti la prescrizione delle seguenti composizioni medicinali:"
COMPOSIZIONI per somministrazioni ad uso diverso da quello parenterale, contenenti acetildiidrocodeina, etilmorfina, folcodina, nicocodina, nicodicodina, norcodeina e loro sali in quantità, espressa in base anidra, superiore a 10 mg fino a 100 mg, per unità di somministrazione o in quantità percentuale, espressa in base anidra, compresa tra l'1% ed il 2,5% p/v (peso/volume) della soluzione multidose; Composizioni per somministrazione rettale contenenti acetildiidrocodeina, etilmorfina, folcodina, nicocodina, nicodicodina, norcodeina e loro sali in quantità, espressa in base anidra, superiore a 20 mg fino a 100 mg per unità di somministrazione.
COMPOSIZIONI per somministrazioni ad uso diverso da quello parenterale, contenenti codeina** e diidrocodeina**, in quantità, espressa in base anidra, superiore a 10 mg per unità di somministrazione o in quantità percentuale, espressa in base anidra, superiore all'1% p/v (peso/volume) della soluzione multidose; Composizioni per somministrazione rettale contenenti acetildiidrocodeina, etilmorfina, folcodina, nicocodina, nicodicodina, norcodeina e loro sali in quantità, espressa in base anidra, superiore a 20 mg per unità di somministrazione.
Al punto precedente compare la precisazione "contenenti codeina** e diidrocodeina**", mentre ante-legge i due codeinici erano separati da una virgola. Data l'accuratezza con cui vengono compilate le tabelle, per evitare il contrasto con la tabella E, rimasta invariata, qualora si eccedano i quantitativi da questa previsti, si dovrebbe/potrebbe ritenere che la sola combinazione delle due permette di usare la RNR. Questa ambiguità sembra avvalorata dal fatto che per le preparazioni ad uso rettale, i due codeinici sono riportati separati da una virgola: se la dose è inferiore a 20 mg, si ricade nella disciplina della sezione E in cui - coerentemente - i due codeinici sono comunque separati da una virgola. Dopo questa segnalazione al Ministero della Salute, lo stesso ha separato codeina e diidrocodeina con la disgiunzione "o". Sebbene questa modifica non sia riportata nella Gazzetta Ufficiale, è comunque sufficiente per avvalorare l'analogia con le precedenti tabelle [NdR]
COMPOSIZIONI ad uso diverso da quello parenterale contenenti fentanyl**, idrocodone**, idromorfone**, morfina**, ossicodone**, ossimorfone
COMPOSIZIONI per somministrazioni ad uso transdermico contenenti buprenorfina**
COMPOSIZIONI di difenossilato contenenti, per unità di dosaggio, come massimo 2,5 mg di difenossilato calcolato come base anidra e come minimo una quantità di solfato di atropina pari all'1 per cento della quantità di difenossilato.
COMPOSIZIONI di difenossima contenenti, per unità di dosaggio, come massimo 0,5 mg di difenossina e come minimo una quantità di atropina pari al 5 per cento della quantità di difenossina.
COMPOSIZIONI che contengono, per unità di somministrazione, non più di 0,1 g di propiram mescolati ad una quantità almeno uguale di metilcellulosa.
COMPOSIZIONI per uso parenterale
contenenti:
clormetildiazepam
(delorazepam)
diazepam
lorazepam
midazolam
f) nella sezione E (ricetta ripetibile, valida 30 gg e per tre volte - DM 9 agosto 06) della tabella II sono indicati:
1) le composizioni medicinali contenenti le sostanze elencate nella tabella II, sezioni A o B, da sole o in associazione con altri principi attivi, quando per la loro composizione qualitativa e quantitativa o per le modalità del loro uso, possono dar luogo a pericolo di abuso o generare farmacodipendenza di grado inferiore a quello delle composizioni medicinali elencate nella tabella II, sezioni A, C o D.
tab. II sez. E
COMPOSIZIONI per somministrazioni ad uso diverso da quello parenterale contenenti acetildiidrocodeina, codeina**, diidrocodeina**, etilmorfina, folcodina, nicocodina, nicodicodina, norcodeina e loro sali in quantità, espressa in base anidra, non superiore a 10 mg per unità di somministrazione o in quantità percentuale, espressa in base anidra, inferiore all'1% p/v (peso/volume) della soluzione multidose; Composizioni per somministrazione rettale contenenti acetildiidrocodeina, codeina**, diidrocodeina**, etilmorfina, folcodina, nicocodina, nicodicodina, norcodeina e loro sali in quantità, espressa in base anidra, non superiore a 20 mg per unità di somministrazione.
COMPOSIZIONI le quali, in associazione con altri principi attivi, contengono i barbiturici od altre sostanze ad azione ipnotico sedativa comprese nelle tabelle II sezione A e II sezione B [per la sezione B, si deve far riferimento ai soli medicinali con AIC - NdR] .
COMPOSIZIONI per uso diverso da quello iniettabile che contengono destropropossifene in associazione con altri principi attivi.
COMPOSIZIONI ad uso diverso da quello parenterale contenenti:
| Alazepam | Medazapam |
| Alprazolam | Meprobamato |
| Bromazepam | Midazolam |
| Brotizolam | Nimetazepam |
| Clobazam | Nitrazepam |
| Clonazepam | Nordazepam |
| Clorazepato | Ossazepam |
| Clordiazepossido | Ossazolam |
| Clotiazepam | Pinazepam |
| Delorazepam | Prazepam |
| Diazepam | Quazepam |
| Estazolam | Temazepam |
| Etizolam | Tetrazepam |
| Flurazepam | Triazolam |
| Ketazolam | Zaleplon |
| Lorazepam | Zolpidem |
| Lormetazepam | Zopiclone |
Composizioni medicinali per uso diverso da quello iniettabile che contengono Destropropossifene in associazione con altri princìpi attivi.
Le sostanze incluse nelle tabelle sono indicate con la denominazione comune internazionale, il nome chimico, la denominazione comune italiana o l'acronimo, se esiste. E', tuttavia, ritenuto sufficiente, ai fini della applicazione del presente testo unico, che nelle tabelle la sostanza sia indicata con almeno una delle denominazioni sopra indicate, purché idonea ad identificarla.
Le sostanze e le piante di cui al comma 1, lettera a), sono soggette alla disciplina del presente testo unico anche quando si presentano sotto ogni forma di prodotto, miscuglio o miscela».
«1. La vendita o cessione, a qualsiasi titolo, anche gratuito, delle sostanze e dei medicinali compresi nelle tabelle I e II di cui all'articolo 14 deve essere fatta alle persone autorizzate a norma del presente testo unico in base a richiesta scritta da staccarsi da apposito bollettario «buoni acquisto» conforme al modello predisposto e distribuito dal Ministero della salute. La richiesta scritta non e' necessaria per la vendita o cessione a qualsiasi titolo ai titolari o direttori di farmacie aperte al pubblico o ospedaliere per quanto attiene ai medicinali compresi nella tabella II, sezioni D ed E, acquistati presso le imprese autorizzate al commercio all'ingrosso. I titolari o i direttori di farmacie aperte al pubblico o ospedaliere possono utilizzare il bollettario «buoni acquisto» anche per richiedere, a titolo gratuito, i medicinali compresi nella tabella II, sezioni A, B e C, ad altre farmacie aperte al pubblico o ospedaliere, qualora si configuri il carattere di urgenza terapeutica»;
La prescrizione dei medicinali indicati nella tabella II, sezione A, di cui all'articolo 14 può comprendere un solo medicinale per una cura di durata non superiore a trenta giorni, ad eccezione della prescrizione dei medicinali di cui all'allegato III-bis per i quali la ricetta può comprendere fino a due medicinali diversi tra loro o uno stesso medicinale con due dosaggi differenti per una cura di durata non superiore a trenta giorni.
Nella ricetta devono essere indicati:
4. Le ricette di cui al comma 1 sono compilate in duplice copia a ricalco per i medicinali non forniti dal Servizio sanitario nazionale, ed in triplice copia a ricalco per i medicinali forniti dal Servizio sanitario nazionale. Una copia della ricetta è comunque conservata dall'assistito o dal proprietario dell'animale ammalato. Il Ministero della salute stabilisce con proprio decreto la forma ed il contenuto del ricettario di cui al comma 1.
5. La prescrizione dei medicinali compresi nella tabella II, sezione A, di cui all'articolo 14, qualora utilizzati per il trattamento di disassuefazione dagli stati di tossicodipendenza da oppiacei o di alcooldipendenza, è effettuata utilizzando il ricettario di cui al comma 1 nel rispetto del piano terapeutico predisposto da una struttura sanitaria pubblica o da una struttura privata autorizzata ai sensi dell'articolo 116 e specificamente per l'attività di diagnosi di cui al comma 2, lettera d), del medesimo articolo. La persona alla quale sono consegnati in affidamento i medicinali di cui al presente comma è tenuta ad esibire a richiesta la prescrizione medica o il piano terapeutico in suo possesso.
I medici chirurghi e i medici veterinari sono autorizzati ad approvvigionarsi attraverso autoricettazione, a trasportare e a detenere i medicinali compresi nell'allegato III-bis per uso professionale urgente, utilizzando il ricettario di cui al comma 1. Una copia della ricetta è conservata dal medico chirurgo o dal medico veterinario che tiene un registro delle prestazioni effettuate, annotandovi le movimentazioni, in entrata ed uscita, dei medicinali di cui si è approvvigionato e che successivamente ha somministrato. Il registro delle prestazioni non è di modello ufficiale e deve essere conservato per due anni a far data dall'ultima registrazione effettuata; le copie delle autoricettazioni sono conservate, come giustificativo dell'entrata, per lo stesso periodo del registro.
Articolo 45 - Dispensazione dei medicinali (aggiornato dalla L. 15 marzo 2010 in G.U. 19 marzo 2010, n. 65)
1. La dispensazione dei medicinali compresi nella tabella II, sezione A, di cui all'articolo 14 e' effettuata dal farmacista che si accerta dell'identita' dell'acquirente e prende nota degli estremi di un documento di riconoscimento da trascrivere sulla ricetta.
2. Il farmacista dispensa i medicinali di cui al comma 1 dietro presentazione di prescrizione medica compilata sulle ricette previste dal comma 1 dell'articolo 43 nella quantita' e nella forma farmaceutica prescritta.
3. Il farmacista ha l'obbligo di accertare che la ricetta sia stata redatta secondo le disposizioni stabilite nell'articolo 43, di annotarvi la data di spedizione e di apporvi il timbro della farmacia e di conservarla tenendone conto ai fini del discarico dei medicinali sul registro di entrata e uscita di cui al comma 1 dell'articolo 60.
3-bis. Il farmacista spedisce comunque le ricette che prescrivano un quantitativo che, in relazione alla posologia indicata, superi teoricamente il limite massimo di terapia di trenta giorni, ove l'eccedenza sia dovuta al numero di unità posologiche contenute nelle confezioni in commercio.
esempio: il medicinale M contiene n unità posologiche; il medico prescrive una posologia che per trenta giorni residua x unità posologiche [NdR].
In caso di ricette che prescrivano una cura di durata superiore a trenta giorni, il farmacista consegna un numero di confezioni sufficiente a coprire trenta giorni di terapia, in relazione alla posologia indicata, dandone comunicazione al medico prescrittore.
esempio: il medicinale M contiene n unità posologiche; il medico prescrive due confezioni che superano i trenta giorni di terapia. Il farmacista consegna solo una confezione di M [NdR].
4. La dispensazione dei medicinali di cui alla tabella II, sezioni B e C, e' effettuata dal farmacista dietro presentazione di ricetta medica da rinnovarsi volta per volta. Il farmacista appone sulla ricetta la data di spedizione e il timbro della farmacia e la conserva tenendone conto ai fini del discarico dei medicinali sul registro di entrata e di uscita di cui all'articolo 60, comma 1.
5. Il farmacista conserva per due anni, a partire dal giorno dell'ultima registrazione nel registro di cui all'articolo 60, comma 1, le ricette che prescrivono medicinali compresi nella tabella II, sezioni A, B e C. Nel caso di fornitura di medicinali a carico del Servizio sanitario nazionale, il farmacista e' tenuto a conservare una copia della ricetta originale o fotocopia.
6. Il Ministro della sanità è delegato a stabilire, con proprio decreto, la forma ed il contenuto dei moduli idonei al controllo del movimento delle sostanze stupefacenti e psicotrope tra le farmacie interne degli ospedali e singoli reparti.
6-bis. All'atto della dispensazione dei medicinali inseriti nella sezione D della tabella II, successivamente alla data del 15 giugno 2009, limitatamente alle ricette diverse da quella di cui al decreto del Ministro della salute 10 marzo 2006, pubblicato nella Gazzetta Ufficiale n. 76 del 31 marzo 2006, o da quella del Servizio sanitario nazionale, disciplinata dal decreto del Ministro dell'economia e delle finanze 17 marzo 2008, pubblicato nel supplemento ordinario alla gazzetta Ufficiale n. 86 dell' 1 aprile 2008, il farmacista deve annotare sulla ricetta il nome, il cognome e gli estremi di un documento di riconoscimento dell'acquirente.
Il farmacista conserva per due anni, a partire dal giorno dell'ultima registrazione, copia o fotocopia della ricetta ai fini della dimostrazione della liceità del possesso dei farmaci consegnati dallo stasso farmacista al paziente o alla persona che li ritira.
L'oscura chiarezza del secondo periodo è interessante: a) non è chiaro cosa debbe intendersi per "copia"... può essere una copia scritta a mano? b) il farmacista (che trattiene copia o fotocopia della ricetta) consegna l'originale (dopo avervi annotato nome cognome ed estremi del documento di riconoscimento dell'acquirente) al paziente o alla persona che ritira il medicinale. Non dovrebbe (il condizionale è d'obbligo) esservi dubbio che (salvo in caso richiamato dal comma 5) il farmacista debba operare a modalità invertite: trattiene l'originale (dopo avervi annotato nome cognome ed estremi del documento di riconoscimento dell'acquirente) e fornisce una copia (anche una dichiarazione con il timbro della farmacia) o fotocopia della ricetta originale al paziente o alla persona che ritira il medicinale. (NdR).
5. Il farmacista conserva per due anni, a partire dal giorno dell'ultima registrazione nel registro di cui all'articolo 60, comma 1, le ricette che prescrivono medicinali compresi nella tabella II, sezioni A, B e C. Nel caso di fornitura di medicinali a carico del Servizio sanitario nazionale, il farmacista e' tenuto a conservare una copia della ricetta originale o fotocopia della ricetta originale, recante la data di spedizione.
6. La dispensazione dei medicinali di cui alla tabella II, sezione D, e' effettuata dal farmacista dietro presentazione di ricetta medica da rinnovarsi volta per volta.
7. La dispensazione dei medicinali di cui alla tabella II, sezione E, e' effettuata dal farmacista dietro presentazione di ricetta medica.
8. Decorsi trenta giorni dalla data del rilascio, la prescrizione medica non puo' essere piu' spedita.
9. Salvo che il fatto costituisca reato, il contravventore alle disposizioni del presente articolo e' soggetto alla sanzione amministrativa pecuniaria del pagamento di una somma da euro 100 ad euro 600.
10. Il Ministro della salute provvede a stabilire, con proprio decreto, tenuto conto di quanto previsto dal decreto ministeriale 15 luglio 2004 in materia di tracciabilita' di medicinali, la forma ed il contenuto dei moduli idonei al controllo del movimento dei medicinali a base di sostanze stupefacenti o psicotrope tra le farmacie interne degli ospedali e singoli reparti.
10-bis. Su richiesta del cliente e in caso di ricette che prescrivono più confezioni, il farmacista, previa specifica annotazione sulla ricetta, può spedirla in via definitiva consegnando un numero di confezioni inferiore a quello prescritto, dandone comunicazione al medico prescrittore, ovvero può consegnare, in modo frazionato, le confezioni, purché entro il termine di validità della ricetta e previa annotazione del numero di confezioni volta per vola consegnato.
Qualora la prescizione non sia a carico del SNN, in caso di dispensazione frazionata, il farmacista trattiene comunque la ricetta su cui annota le confezioni consegnate e fornisce copia della ricetta alla persona che ritira il medicinale (NdR
Al farmacista compete (Art. 46) anche la conservazione e documentazione nei registri di carico e scarico e di entrata-uscita. Nello schema sottostante, con l'abbreviazione "E/U" si è indicato il registro di entrata-uscita. Non è necessario documentare la movimentazione per i medicinali regolamentati dalla tab. II sez. D e sez. E.
| classificazione | tipo ricetta | registrazione |
| II sez. A | massimo 30 giorni di terapia; indirizzo e "tutte lettere" non
obbligatorio RMR con uno o due tipi di medicinali (preparati o dosaggi diversi) |
Registro E/U Acquisto con BA |
| II sez. B | RNR valida 30 gg (per formule magistrali e officinali) | Registro E/U Acquisto con BA |
| II sez. C | RNR valida 30 gg | Registro E/U Acquisto con BA |
| II sez. D | RNR valida 30 gg; | Registro E/U |
| II sez. E | RR (valida 30 gg , massimo 3 dispensazioni) | Registro E/U |
Per quanto attiene i medicinali, gli esempi proposti sono riferiti a prodotti per i quali è stata già rilasciata una AIC non potendosi prevedere con certezza le decisioni del Ministero della Salute (vedasi note in calce alle tab. 4 e 5 della F.U. XI ed.)
| esempio 2: il Liberen® è un medicinale contenente compresse da 30 mg di destropropossifene: un derivato sintetico del metadone iscritto nelle tab. II sez. B (prep. magistrali) e sez. C (da solo o in forma iniettabile) e in tab. II sez. E (non iniettabile ed in associazione con altri princìpi attivi). Il Liberen ricade quindi nella disciplina della tab. II sez. C, per cui è necessaria la ricetta non ripetibile con obbligo di registrarne la movimentazione nel registro E/U |
| esempio 3: EN® fiale (classe SSN C) è una benzodiazepina (Delorazepam) ammessa per uso parenterale; le uniche benzodiazepine ammesse anche per uso iniettivo oltre al Delorazepam sono: Diazepam, Lorazepam e Midazolam. Ricadono tutte in tab. II sez. D per cui sono dispensabili dietro presentazione di RNR (senza obbligo di registrarne la movimentazione)
esempio 3 bis: il Mogadon® è un medicinale contenente 20 cpr da 5 mg di nitrazepam: in questo caso, trattandosi di una benzodiazepina non destinata all'uso parenterale, si ricade nella tab. II sez. E per la quale è sufficiente la ricetta ripetibile limitata a tre volte in 30 giorni. Questo vale per tutti i medicinali contenenti le benzodiazepine (per uso non parenterale), con esclusione del flunitrazepam (cfr. esempio 1) che essendo iscritto nella tab. II sez. A, richiede la ricetta a ricalco. |
| esempio 4: il sodio oxibato (acido gamma-idrossibutirrico) è iscritto nella tab. II sez. B. Non essendo tale sostanza presente in una delle successive sezioni, si deve dedurre - e ciò vale in generale - che oltre alla sostanza stessa, anche le preparazioni medicinali che la comprendono (Alcover, classe H) devono appartenere alla tab. II sez. B (RNR). |
esempio 5: La dispensazione di un medicinale o prep. magistrale contenente un barbiturico può rientrare in quattro diverse sezioni di tab. II e quindi essere sottoposta ad una diversa disciplina:
|
| esempio 6: Metinal Idantoina L cpr, è un medicinale contenente fenitoina (difenilidantoina), metilfenobarbital, fenobarbital. Questa associazione, essendo costituita da due barbiturici (entrambi iscritti nella tab. II sez. B) in associazione (nella fattispecie con un antiepilettico), come medicinale (con AIC) ricade nella disciplina della tab. II sez. E, per cui richiede la RR, valida 30 gg e per tre volte. La stessa associazione, non può essere allestita in farmacia in quanto le associazioni di due sostanza stupefacenti sono esplicitamente escluse. |
| esempio 7: in Italia non esistono al momento medicinali contenenti difenossina, o difenossilato. Il Lomotil® è un antidiarroico - composto da difenossilato 2,5 mg e atropina solfato 0,025 mg - distribuito dalla Pfizer negli Usa; se fosse disponibile, rientrerebbe nella disciplina della tab. II sez. D e per la sua dispensazione richiederebbe la ricetta non ripetibile. |
| esempio 8: Marinol® (Roxane) e Cesamet® (Valeant Pharmaceuticals International) sono due medicinali rispettivamente contenenti dronabinol e nabilone. In vendita in Usa, Canada, Inghilterra e Germania non hanno una AIC per l'Italia. Comunque, poiché la nuova disciplina ne prevede l'impiego in Italia, se fossero disponibili, per la loro dispensazione richiederebbero la ricetta non ripetibile, RNR. |
| esempio 9: Una composizione contenente 8 unità posologiche da 10 mg di folcodina corrisponde al limite massimo per essere assoggettata alla disciplina della tab. II sez. E, per cui è sufficiente la ricetta ripetibile, RR limitata a 30 gg.
esempio 9 bis: Una composizione contenente 8 unità posologiche da 120 mg di folcodina supera il limite massimo per essere assoggettata alla disciplina della tab. II sez. D, per cui è necessaria la RaR. |
| esempio 10: il medicinale Mindol Merck contiene 5 mg di etilmorfina cloridrato e quindi ricade nella disciplina della tab. II sez. E che richiede la ricetta ripetibile per stupefacenti. |
| esempio 11: una preparazione estemporanea oppure una associazione di medicinali costituita da morfina solfato e diazepam, per la terapia del dolore (e solo in questo caso) può essere dispensata dietro presentazione di un'unica ricetta RMR, oppure di ricetta regionale del SSN, oppure di ricetta NR. |
| esempio 12: lo schema in fugura, riassume sinteticamente la disciplina della codeina e diidrocodeina per uso non parenterale (v. es. 13 e 14) |
 |
| esempio 13: il Senodin An sciroppo è un medicinale contenente codeina fosfato (158,5 mg in 100 ml) e profenpiridamina maleato (83 mg in 100 ml). La codeina fosfato è iscritta nella tab. II sez. A; ma in questo caso, è presente nello sciroppo in un dosaggio che rientra nella disciplina della tab. II sez. E (RR, valida 30 gg e per tre volte) in quanto la quantità di codeina (1,36 g di codeina fosfato corrispondono a 1 g di base anidra) espressa come base anidra è 0,116 g (0,11 6g/100 ml < 1%). |
 Il confronto con l'attuale disciplina degli stupefacenti può suscitare perpressità ove la si confronti con la precedente - molto più restrittiva - che prevedeva oltre i dosaggi per dose unitaria anche le dosi complessive. Per questo, a fugare dubbi, occorre riferirsi ai "considerando" della legge che sono di aiuto nell'interpretazione della stessa. Appunto nei "considerando" del Decreto 26 settembre 2010 in GU n.242 del 15-10-2008, compare la seguente frase: "Ritenuto di riferire, al fine della iscrizione dei medicinali nella tabella II, sezioni D ed E, i valori massimi di principio attivo contenuto nelle composizioni monodose alle sole unità di somministrazione e non anche alla quantità totale per confezione;"
Il confronto con l'attuale disciplina degli stupefacenti può suscitare perpressità ove la si confronti con la precedente - molto più restrittiva - che prevedeva oltre i dosaggi per dose unitaria anche le dosi complessive. Per questo, a fugare dubbi, occorre riferirsi ai "considerando" della legge che sono di aiuto nell'interpretazione della stessa. Appunto nei "considerando" del Decreto 26 settembre 2010 in GU n.242 del 15-10-2008, compare la seguente frase: "Ritenuto di riferire, al fine della iscrizione dei medicinali nella tabella II, sezioni D ed E, i valori massimi di principio attivo contenuto nelle composizioni monodose alle sole unità di somministrazione e non anche alla quantità totale per confezione;"
Ciò premesso, sembra che la responsabilità del farmacista sia limitata al controllo dei formalismi e adempimenti richiesti dalla ricetta (v. Cassazione) e non ai dosaggi riportati sulla stessa; per questi, risulta responsabile il medico che può essere chiamato a rispondere dell'appropriatezza prescrittiva in sede penale e civile.
| esempio 14: una preparazione estemporanea per 40 capsule di diidrocodeina, ciascuna da 10 mg da somministrare in ragione di due capsule ogni 6 ore, richiede una ricetta ripetibile. Una preparazione estemporanea per 20 capsule di codeina, ciascuna da 20 mg da somministrare in ragione di una capsula ogni 6 ore richiede una ricetta non ripetibile. In questo caso, la prima ricetta è una prescrizione inappropriata per la posologia (due compresse per volta), ma anche deontologicamente in quanto sottrae il paziente al controllo del medico. |
| esempio 15: in G.U. n 154 del 30 aprile 2013, è stata pubblicata l'Autorizzazione all'immissione in commercio del medicinale per uso umano "Sativex". Sativex è un estratto totale della pianta di Cannabis, standardizzato; contiene due principi attivi, quasi in uguale quantità: delta-9-Tetraidrocannabinolo (THC) e Cannabidiolo (CBD).
E' registrato per alleviare i sintomi in pazienti adulti affetti da spasticità da moderata a grave nella sclerosi multipla (SM) che non hanno manifestato una risposta adeguata ad altri medicinali antispastici e che hanno mostrato un miglioramento clinicamente significativo dei sintomi associati alla spasticità nel corso di un periodo di prova iniziale della terapia. Il medicinale è dispensabile mediante ricetta medica limitativa, da rinnovare volta per volta, vendibile al pubblico su prescrizione di centri ospedalieri o di specialisti - neurologo (RNRL). Per quanto attiene la preparazione di galenici magistrali, i medicinali vegetali a base di Cannabis possono essere allestiti solo alle condizioni previste in sede di AIC per i medicinali industriali corrispondenti. Pertanto i preparati magistrali a base di Cannabis, come per i medicinali con AIC, sono dispensabili dietro presentazione di RNR limitativa prescritta da centri ospedalieri o da specialista neurologo. |
| 4 | ||||||
Marcello Guidotti - Tommasina Coviello (2 maggio 2013)
I contenuti e l'impostazione di questa pagina, riportano una sintesi e riadattamento a fini didattici delle tabelle della F.U. XII con le modificazioni introdotte dalla legge sugli stupefacenti.