il potenziale zeta (pζ)
Una particella dispersa in un liquido generalmente presenta delle cariche elettrostatiche superficiali (per es. prodotte durante la polverizzazione) che determinano un campo elettrico responsabile della ridistribuzione degli ioni presenti nello spazio che circonda la particella. Questa distribuzione comporta un aumento della concentrazione di controioni (ioni di carica opposta a quella della particella) in prossimità della superficie. In particolare, lo strato di liquido con gli ioni che circonda la particella è composto da due zone: una interna (strato stazionario, o di Stern) con gli ioni fortemente legati alla particella carica, ed una esterna (strato diffuso, o di Gouy-Chapman), dove le interazioni sono più deboli. Le due zone, costituiscono un doppio strato elettrico intorno a ciascuna particella.
All'interno dello strato diffuso - di spessore molto maggiore rispetto allo strato di Stern - gli ioni formano strutture metastabili: quando la particella si muove nel liquido, gli ioni si muovono con essa; in particolare, quelli oltre il piano di taglio (shear plane) sostituiscono e sono continuamente sostituiti dagli ioni liberi presenti nel liquido in modo che le dimensioni del doppio strato, determinate dal potenziale zeta (v. avanti) rimangano costanti.
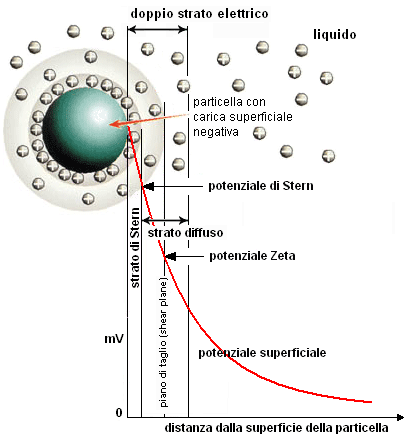 Il grafico a destra mostra, per una generica particella carica, la variazione del potenziale elettrico in funzione della distanza dalla sua superficie: si può vedere come questo diminuisca rapidamente all'interno dello strato stazionario, più lentamente all'interno dello strato diffuso e poi ancóra più lentamente fino ad annullarsi, per definizione, all'infinito.
Il grafico a destra mostra, per una generica particella carica, la variazione del potenziale elettrico in funzione della distanza dalla sua superficie: si può vedere come questo diminuisca rapidamente all'interno dello strato stazionario, più lentamente all'interno dello strato diffuso e poi ancóra più lentamente fino ad annullarsi, per definizione, all'infinito.
In particolare, poiché la carica intrinseca sulla superficie della particella è schermata dalle cariche dello strato stazionario, le interazioni fra particelle saranno ovviamente regolate proprio dal potenziale presente alla superficie di questo strato. Immaginiamo dunque di allontanarci dalla superficie delle particella, per raggiungere, lungo la curva di potenziale in figura, il piano di taglio: il potenziale presente in questo punto prende il nome di potenziale zeta (p ζ) e definisce il comportamento dei sistemi dispersi, in particolare delle sospensioni.

E' possibile modificare il potenziale ζ aggiungendo elettroliti, in modo che i loro ioni vengano adsorbiti sulla superficie delle particelle. Si può anche ricorrere all'aggiunta di tensioattivi, che funzionano da agenti bagnanti per le particelle liofobe. In particolare:
- i tensioattivi anionici aumentano il pζ negativo intrinseco delle particelle in quanto queste adsorbiranno cariche negative;
- i tensioattivi cationici diminuiscono il pζ fino ad invertirne addirittura il segno;
- i tensioattivi non ionici, vengono adsorbiti creando una barriera all'avvicinamento delle particelle.
in tutti questi casi, appropriate misure elettroforetiche (v. avanti) permetteranno di valutare le variazioni del pζ, fornendo indicazioni per intervenire su di esso.
importanza pratica del potenziale zeta
Quando due particelle sono così vicine che i loro doppi strati si sovrappongono, si respingono reciprocamente con una forza elettrostatica la cui intensità dipende dal potenziale zeta: se è troppo basso (tipicamente inferiore a ±25 mV), la forza repulsiva non sarà abbastanza forte da superare l'attrazione di van der Waals fra le particelle, e queste inizieranno ad agglomerarsi. Quando questo accade la sospensione è instabile.
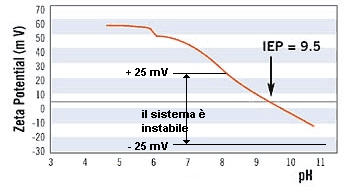
andamento tipico del potenziale ζ al variare del pH .
In questo caso la stabilitÓ Ŕ possibile solo per valori
di pH inferiori a 8
|
Un alto potenziale zeta impedisce l'agglomerazione delle particelle e mantiene la dispersione uniforme e libera di scorrere. Di conseguenza, per la preparazione della maggior parte delle formulazioni, l'obiettivo è massimizzare il potenziale zeta.
Il potenziale ζ dipende dalla densità della carica superficiale e dallo spessore del doppio strato. La densità della carica superficiale, a sua volta, dipende dalla concentrazione del potenziale prodotto dagli ioni nei solventi ionici che hanno un'affinità particolare per la superficie. In molti sistemi, lo ione H+ determina il potenziale e così il potenziale ζ dipende dal pH.
Il potenziale ζ è positivo per bassi valori di pH e negativo per valori alti. Il pH per cui il potenziale ζ è nullo definisce il punto isoelettrico (IEP = IsoElectric Point) del sistema disperso. Il punto isoelettrico è una proprietà della superficie della particella ed è il valore intorno al quale si ha scarsa stabilità in quanto sono più evidenti le forze di van der Waals.
misura del potenziale zeta
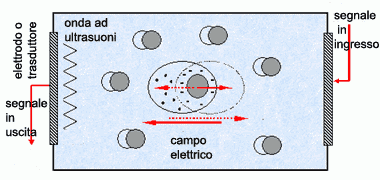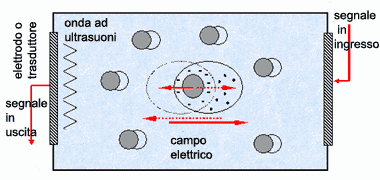
modificato da: www.istec.cnr.it |
La stabilità delle dispersioni, data la tendenza a respingersi delle particelle di carica opposta, è fortemente influenzata dalla carica superficiale. Se si applica un campo elettrico al mezzo liquido le particelle disperse si muoveranno verso il polo di carica opposta; pertanto, la direzione dello spostamento indica chiaramente il segno della carica sulla superficie. La velocità con cui si muovono le particelle è proporzionale alla grandezza della carica e misurando sia la velocità sia la direzione dello spostamento in un campo elettrico noto è possibile calcolare la Mobilità Elettroforetica e da qui il Potenziale Zeta del sistema.
Se le particelle cariche disperse sono sottoposte all'azione di un campo elettrico oscillante, prendono un movimento di "va' e vieni" verso gli elettrodi; questo comporta cambiamenti nella densità che generano onde elastiche alla superficie degli elettrodi come eco dell'eccitazione (effetto ESA: Electrokinetic Sonic Amplitude). L'ampiezza, A, della risposta acustica (visualizzata su monitor) è proporzionale alla velocità della particella, a sua volta indotta dall'intensità del campo elettrico, E, secondo la relazione: A = μ E
La "costante" di proporzionalità, μ, è la mobilità dinamica, che dipende della dimensione delle particelle, dal potenziale zeta, dalla frequenza e dal ritardo di fase della velocità delle particelle in funzione della frequenza di eccitazione. Questa dipendenza è usata per ricavare la dimensione delle particelle e la carica superficiale (potenziale zeta).
Le misure sono effettuate in un intervallo di frequenze tra 0,3 e 15 MHz. Il vantaggio della misura elettroacustica e che essa può essere impiegata su sistemi non diluiti: la diluizione può alterare sia la dimensione che il potenziale zeta in conseguenza di cambiamenti imprevedibili nelle proprietà superficiali delle particelle sospese. Con questa tecnologia è teoricamente possibile misurare campioni in un intervallo di concentrazione del 40% come frazione in volume di particelle aventi dimensioni da 1 nm a 10 μm.
Marcello Guidotti, copyright 2003-2004-2006-2007
questa pagina può essere riprodotta su qualsiasi supporto o rivista purché sia citata la fonte e l'indirizzo di questo sito (ai sensi degli artt. 2575 e 2576 cc. Legislazione sul diritto d'autore). Le fotografie sono tratte da siti web e costituiscono materiale pubblicitario, oppure sono, o possono ritenersi, di pubblico dominio purché utilizzate senza fini di lucro.
 Il grafico a destra mostra, per una generica particella carica, la variazione del potenziale elettrico in funzione della distanza dalla sua superficie: si può vedere come questo diminuisca rapidamente all'interno dello strato stazionario, più lentamente all'interno dello strato diffuso e poi ancóra più lentamente fino ad annullarsi, per definizione, all'infinito.
Il grafico a destra mostra, per una generica particella carica, la variazione del potenziale elettrico in funzione della distanza dalla sua superficie: si può vedere come questo diminuisca rapidamente all'interno dello strato stazionario, più lentamente all'interno dello strato diffuso e poi ancóra più lentamente fino ad annullarsi, per definizione, all'infinito.


