polveri
La più semplice forma farmaceutica è costituita dalle polveri, galeniche o industriali che devono soddisfare specifici requisiti indicati dalla F.U.
La formulazione di farmaci in polveri, per impieghi non aspersori, è a volte preferibile rispetto alle compresse sia per la possibilità di adattare meglio la dose al paziente, sia per la maggior biodisponibilità dovuta all'eliminazione della fase di disaggregazione della compressa. La superficie specifica delle particelle che costituiscono la polvere, influenza la velocità di dissoluzione o addirittura l'attività nel caso di sostanze poco solubili.
 Durante il mescolamento di due polveri, si possono formare miscele eutettiche, caratterizzate da un punto di fusione inferiore a quello dei singoli componenti con possibile rammollimento e liquefazione della miscela a temperatura ambiente.
Durante il mescolamento di due polveri, si possono formare miscele eutettiche, caratterizzate da un punto di fusione inferiore a quello dei singoli componenti con possibile rammollimento e liquefazione della miscela a temperatura ambiente.
Questo fenomeno, che può verificarsi anche dopo un certo tempo, si può spiegare considerando che la miscela di due polveri fa sì che venga reciprocamente ridotta la simmetria dei loro reticoli cristallini, con riduzione delle forze intermolecolari e conseguente abbassamento del punto di fusione.
La lavorazione di una preparazione eutettica comporta difficoltà sia a livello galenico che industriale. Un metodo per evitare il problema consiste nel mescolare le polveri, o preferibilmente i cristalli, senza triturarle, in modo da ridurne la superficie di contatto. Si può anche usare un un terzo componente (ad es. caolino, talco, ecc.) che, miscelato al primo, agendo da barriera protettiva limita il contatto tra le polveri eutettiche; oppure lasciare rammollire le polveri e quindi correggerne la consistenza facendole adsorbire su talco o caolino.
Qualora questi accorgimenti, particolarmente a livello galenico, si dimostrassero inadeguati, occorrerà separare i componenti in due cartine o cialde, indicando nell'etichetta della confezione che le cartine o cialde "A" e "B" devono essere riunite al momento dell'uso.
 Da quanto discusso, segue che il punto di fusione di una polvere può essere assunto quale criterio di purezza, in quanto eventuali particelle estranee ne abbassano il valore. A rigore, l'abbassamento del punto di fusione si verifica solo in un sistema ideale in cui, per definizione, i due solidi siano solubili allo stato fuso (es., le coppie metalliche Al-Sn, Si-Al, Ob-Ag, i sali fusi tipo KCl-AgCl, o sostanze organiche come cicloesano-benzene).
Da quanto discusso, segue che il punto di fusione di una polvere può essere assunto quale criterio di purezza, in quanto eventuali particelle estranee ne abbassano il valore. A rigore, l'abbassamento del punto di fusione si verifica solo in un sistema ideale in cui, per definizione, i due solidi siano solubili allo stato fuso (es., le coppie metalliche Al-Sn, Si-Al, Ob-Ag, i sali fusi tipo KCl-AgCl, o sostanze organiche come cicloesano-benzene).
analisi termica di miscele
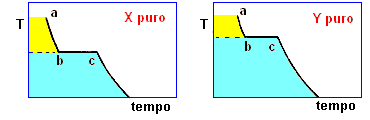 la curva di raffreddamento di X puro (prima figura a sinistra) presenta una diminuzione di temperatura regolare dal punto (a) al punto (b) in accordo con il fatto che diminuisce l'energia cinetica della sostanza. A partire dal punto (b), ha inizio la fase di cristallizzazione, durante la quale la temperatura resta costante. Questo perché le particelle, sempre più lente per la diminuzione della temperatura, si assestano nella loro matrice cristallina e durante la formazione dei legami liberano energia in misura tale da compensare il calore che viene sottratto dal sistema di raffreddamento esterno: la lunghezza del tratto (b-c) è legata al calore latente (proporzionale all'intensità delle forze di legame presenti nel solido puro) tipico della transizione di fase.
la curva di raffreddamento di X puro (prima figura a sinistra) presenta una diminuzione di temperatura regolare dal punto (a) al punto (b) in accordo con il fatto che diminuisce l'energia cinetica della sostanza. A partire dal punto (b), ha inizio la fase di cristallizzazione, durante la quale la temperatura resta costante. Questo perché le particelle, sempre più lente per la diminuzione della temperatura, si assestano nella loro matrice cristallina e durante la formazione dei legami liberano energia in misura tale da compensare il calore che viene sottratto dal sistema di raffreddamento esterno: la lunghezza del tratto (b-c) è legata al calore latente (proporzionale all'intensità delle forze di legame presenti nel solido puro) tipico della transizione di fase.
Completata la fase di cristallizzazione, la temperatura di X prende nuovamente a diminuire a séguito della cessione di calore al sistema di raffreddamento.
La curva di raffreddamento di Y puro può essere discussa come per X puro
I diagrammi seguenti, si riferiscono all'analisi termica di due sostanze X ed Y con Tx < Ty.
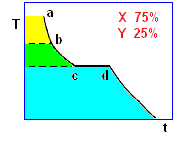 La curva di raffreddamento di una ipotetica miscela composta da X(75%) e Y(25%), presenta tre punti singolari: (b), (c), (d). In particolare, da (a) a (b) si avrà un raffreddamento regolare della miscela finché, in corrispondenza di (b), la cristallizzazione di Y (con maggior temperatura di fusione) comporta arresto termico per tutta la percentuale di questo componente, mentre X continua a raffreddare, però con pendenza diversa, fino al punto (c), corrispondente alla temperatura di equilibrio, Te, dove tutta la massa di X inizia a cristallizzare.
La curva di raffreddamento di una ipotetica miscela composta da X(75%) e Y(25%), presenta tre punti singolari: (b), (c), (d). In particolare, da (a) a (b) si avrà un raffreddamento regolare della miscela finché, in corrispondenza di (b), la cristallizzazione di Y (con maggior temperatura di fusione) comporta arresto termico per tutta la percentuale di questo componente, mentre X continua a raffreddare, però con pendenza diversa, fino al punto (c), corrispondente alla temperatura di equilibrio, Te, dove tutta la massa di X inizia a cristallizzare.
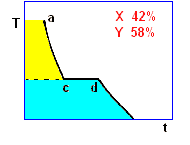 la curva di raffreddamento di una miscela composta da X(42%) e Y(58%), presenta solo due punti singolari: (c), (d). Infatti, diminuendo la percentuale di X, il punto singolare (b) corrispondente al punto di fusione di X (nel grafico precedente), si sposta fino a coincidere (per la particolare composizione ipotizzata) con il punto (c): in questo caso, abbiamo quella che prende il nome di miscela eutettica, caratterizzata da un unico punto di fusione.
la curva di raffreddamento di una miscela composta da X(42%) e Y(58%), presenta solo due punti singolari: (c), (d). Infatti, diminuendo la percentuale di X, il punto singolare (b) corrispondente al punto di fusione di X (nel grafico precedente), si sposta fino a coincidere (per la particolare composizione ipotizzata) con il punto (c): in questo caso, abbiamo quella che prende il nome di miscela eutettica, caratterizzata da un unico punto di fusione.
In genere le strutture con bassi valori di DH e t.f. (canfora, aspirina, ecc.), presentano più marcatamente i fenomeni esaminati. D'altra parte, alcune sostanze mescolate insieme non formano una miscela bassofondente, il cui innesco, però, può essere indotto da un terzo componente: un esempio tipico è offerto dalla miscela fenile salicilato-acetanilide-antipirina.
Fra le sostanze utilizzate per la preparazione di polveri galeniche, quelle che possono formare eutettici sono: acetanilide, acido acetilsalicilico, cloralio idrato, fenacetina, mentolo, fenolo, fenile salicilato (salolo), timolo. Anche le miscele con p.f. dell'eutettico relativamente alto (81-90 oC), possono fondere a temperatura ambiente in quanto, triturandole nel mortaio, si creano attriti che possono produrre, anche solo in alcune zone della miscela, notevoli aumenti della temperatura.
La tabella seguente, riporta alcune miscele eutettiche.
| salolo (41-43 oC) |
+ |
canfora (164-179oC) |
> 10oC |
| salolo (41-43oC) |
+ |
timolo(51oC) |
> 13oC |
| resorcina (110 oC) |
+ |
acetanilide(164-179oC) |
> 33oC |
| pirocatechina (104 oC) |
+ |
acetanilide(164-179oC) |
> 37oC |
| ac. acetilsalicilico (103-106oC) |
+ |
acetanilide(164-179oC) |
> 81oC |
| fenacetina (137 oC) |
+ |
acetanilide(164-179oC) |
> 90oC |
Altre caratteristiche delle polveri sono:
- igroscopicità: tendenza ad assorbire l'umidità dell'aria;
- deliquescenza: il solido si solubilizza nella propria acqua di cristallizzazione senza ssorbirla dall'esterno;
- efflorescenza: perdita di acqua di cristallizzazione (si verifica, per es. con ac. citrico, allume, atropina solfato, caffeina, calcio lattato, codeina fosfato, chinina, terpina idrata, ecc).
Per polverizzare le sostanze che si lavorano difficilmente, si ricorre alla cosiddetta "polverizzazione per intermedio". Per es., la canfora si deforma senza polverizzarsi, per cui la si solubilizza triturandola in un solvente volatile, in modo da ottenere un precipitato polveroso dopo la sua evaporazione. Un altro esempio: il salolo, sottoposto a triturazione, si elettrizza; così, per evitare che le sue particelle -omogeneamente cariche- si respingano spargendosi tutt'intorno, si aggiunge un agente coibente, tipo ligroina, che ne attenua gli effetti elettrostatici.
| mentolo racemico |
1 g |
| talco mentolato q.b a |
100 g |
Una classica preparazione è il mentolo polvere cutanea noto come talco mentolato. Secondo la F.U. XI è una polvere all'1% in mentolo racemico. Si prepara disperdendo il mentolo nel talco aggiunto per diluizioni progressive.
| mentolo |
1 g |
| canfora |
1 g |
| talco |
98 g |
Un'altra comune preparazione è il talco mento-canforato riportato in F.U. VI che essendo costituito da una miscela eutettica, richiede alcune delle accortezze citate per queste preparazioni. Tipicamente si addiziona talco e mentolo e si aggiunge con diluizioni progressive il talco in modo da estinguere la massa deliquescente.
polvere di Dover

Cephaelis ipecacuanha |
Thomas Dover ("medico" e bucaniere inglese, 1660-1742), nel 1710 elaborò un preparato contro la gotta a base d'oppio, liquirizia, salnitro e ipecacuana: la polvere di Dover, che divenne uno dei farmaci più usati del XVII secolo. La polvere di Dover andava sciolta in un bicchiere di latte caldo cagliato con vino bianco e presa prima di andare a letto. «Coprendosi bene e bevendone dalle due alle tre pinte, in modo da sudare molto, in due o tre ore al massimo, il paziente non avvertirà più il dolore», assicurava la formula illustrativa scritta da Dover stesso.
Quando Dover utilizzò dosaggi maggiori, provocò molti problemi, allontanando i medici dall'uso dell'oppio. Così, agli inizi dell'800, i medici adottarono il criterio che «se il paziente si lamenta per i dolori, lasciatelo lamentare. I lamenti non hanno mai ucciso nessuno...»1. Il trattamento del dolore era diventato pericoloso.
La formulazione corrente della polvere di Dover prevede 10 parti di polvere di oppio, 10 parti di polvere di ipecacuana e 80 parti di lattosio (questa preparazione non può essere allestita in quanto l'oppio è unicamente contenuto nella tab. I degli stupefacenti).
La polvere di oppio, in questo caso, ha azione di tipo morfinico ma la presenza dell'ipecacuana non permette di abusarne in quanto quest'ultima droga contiene emetina che a forti concentrazioni induce il vomito. La polvere di Dover contiene l'1% di morfina in quanto la polvere di oppio F.U. contiene il 10% di morfina.
1Abbey Strauss - The Pain Project Volume 2, Issue 1 January 1994
sacchetti refrigeranti
Le miscele eutettiche racchiuse in piccoli involucri sono utilizzate per mantenere valori di bassa temperatura all'interno di un contenitore termico senza utilizzare macchine frigorifere. Queste miscele si ottengono sfruttando soluzioni acquose di opportuni sali.
Un altro impiego comune si ha per i refrigeranti gengivari usati per alleviare i dolori gengivari durante la dentizione dei bambini.
Il principio è il seguente: a temperatura ambiente ed a pressione atmosferica costante, si miscela del ghiaccio tritato con un sale, ad esempio, cloruro di sodio in proporzioni tali da ottenere un sistema formato da due fasi solide (il ghiaccio e il sale) ed una liquida (la soluzione acquosa di cloruro di sodio).
Poiché queste tre fasi possono coesistere solamente al punto eutettico (in questo caso vale - 21,3 °C), a temperatura ambiente non si ha equilibrio e quindi il ghiaccio fonde e viene solubilizzato altro cloruro di sodio. Poiché il processo di fusione richiede assorbimento di calore dall'ambiente esterno, si ha un conseguente effetto refrigerante.
 Mescolando opportune quantità di ghiaccio e sale è possibile formare miscele frigorifere efficienti (ricaricabili mettendole in frigorifero per alcune ore) e con una buona durata nel tempo (arco di ore).
Mescolando opportune quantità di ghiaccio e sale è possibile formare miscele frigorifere efficienti (ricaricabili mettendole in frigorifero per alcune ore) e con una buona durata nel tempo (arco di ore).
Raggiunta la temperatura eutettica, nella quale le tre fasi (f = 3) sono in condizione di equilibrio, il sistema bicomponente (acqua e NaCl, c = 2) è invariante (v = c +1 -f = 2 +1 -3 = 0) e mantiene un valore costante di temperatura fino a quando non viene fuso tutto il ghiaccio o sciolto tutto il sale. Quando è verificata una di queste condizioni il sistema non è più zerovariante e quindi la sua temperatura tende nuovamente ad aumentare fino al raggiungimento della temperatura ambiente.
| 1 |
 2 2 |
 3 3 |
 4 4 |
 5 5 |
 6 6 |
 7 7 |
 8 8 |
 9 9 |
 10 10 |
 11 11 |
 12 12 |
 13 13 |
 14 14 |
 15 15 |
 HOME PAGE HOME PAGE |
Marcello Guidotti, copyright 2003 - 2007
questa pagina può essere riprodotta su qualsiasi supporto o rivista purché sia citata la fonte e l'indirizzo di questo sito (ai sensi degli artt. 2575 e 2576 cc. Legislazione sul diritto d'autore). Le fotografie sono tratte da siti web e costituiscono materiale pubblicitario, oppure sono, o possono ritenersi, di pubblico dominio purché utilizzate senza fini di lucro.
 Durante il mescolamento di due polveri, si possono formare miscele eutettiche, caratterizzate da un punto di fusione inferiore a quello dei singoli componenti con possibile rammollimento e liquefazione della miscela a temperatura ambiente.
Durante il mescolamento di due polveri, si possono formare miscele eutettiche, caratterizzate da un punto di fusione inferiore a quello dei singoli componenti con possibile rammollimento e liquefazione della miscela a temperatura ambiente. la curva di raffreddamento di X puro (prima figura a sinistra) presenta una diminuzione di temperatura regolare dal punto (a) al punto (b) in accordo con il fatto che diminuisce l'energia cinetica della sostanza. A partire dal punto (b), ha inizio la fase di cristallizzazione, durante la quale la temperatura resta costante. Questo perché le particelle, sempre più lente per la diminuzione della temperatura, si assestano nella loro matrice cristallina e durante la formazione dei legami liberano energia in misura tale da compensare il calore che viene sottratto dal sistema di raffreddamento esterno: la lunghezza del tratto (b-c) è legata al calore latente (proporzionale all'intensità delle forze di legame presenti nel solido puro) tipico della transizione di fase.
la curva di raffreddamento di X puro (prima figura a sinistra) presenta una diminuzione di temperatura regolare dal punto (a) al punto (b) in accordo con il fatto che diminuisce l'energia cinetica della sostanza. A partire dal punto (b), ha inizio la fase di cristallizzazione, durante la quale la temperatura resta costante. Questo perché le particelle, sempre più lente per la diminuzione della temperatura, si assestano nella loro matrice cristallina e durante la formazione dei legami liberano energia in misura tale da compensare il calore che viene sottratto dal sistema di raffreddamento esterno: la lunghezza del tratto (b-c) è legata al calore latente (proporzionale all'intensità delle forze di legame presenti nel solido puro) tipico della transizione di fase. La curva di raffreddamento di una ipotetica miscela composta da X(75%) e Y(25%), presenta tre punti singolari: (b), (c), (d). In particolare, da (a) a (b) si avrà un raffreddamento regolare della miscela finché, in corrispondenza di (b), la cristallizzazione di Y (con maggior temperatura di fusione) comporta arresto termico per tutta la percentuale di questo componente, mentre X continua a raffreddare, però con pendenza diversa, fino al punto (c), corrispondente alla temperatura di equilibrio, Te, dove tutta la massa di X inizia a cristallizzare.
La curva di raffreddamento di una ipotetica miscela composta da X(75%) e Y(25%), presenta tre punti singolari: (b), (c), (d). In particolare, da (a) a (b) si avrà un raffreddamento regolare della miscela finché, in corrispondenza di (b), la cristallizzazione di Y (con maggior temperatura di fusione) comporta arresto termico per tutta la percentuale di questo componente, mentre X continua a raffreddare, però con pendenza diversa, fino al punto (c), corrispondente alla temperatura di equilibrio, Te, dove tutta la massa di X inizia a cristallizzare.
 la curva di raffreddamento di una miscela composta da X(42%) e Y(58%), presenta solo due punti singolari: (c), (d). Infatti, diminuendo la percentuale di X, il punto singolare (b) corrispondente al punto di fusione di X (nel grafico precedente), si sposta fino a coincidere (per la particolare composizione ipotizzata) con il punto (c): in questo caso, abbiamo quella che prende il nome di miscela eutettica, caratterizzata da un unico punto di fusione.
la curva di raffreddamento di una miscela composta da X(42%) e Y(58%), presenta solo due punti singolari: (c), (d). Infatti, diminuendo la percentuale di X, il punto singolare (b) corrispondente al punto di fusione di X (nel grafico precedente), si sposta fino a coincidere (per la particolare composizione ipotizzata) con il punto (c): in questo caso, abbiamo quella che prende il nome di miscela eutettica, caratterizzata da un unico punto di fusione.
 Mescolando opportune quantità di ghiaccio e sale è possibile formare miscele frigorifere efficienti (ricaricabili mettendole in frigorifero per alcune ore) e con una buona durata nel tempo (arco di ore).
Mescolando opportune quantità di ghiaccio e sale è possibile formare miscele frigorifere efficienti (ricaricabili mettendole in frigorifero per alcune ore) e con una buona durata nel tempo (arco di ore).