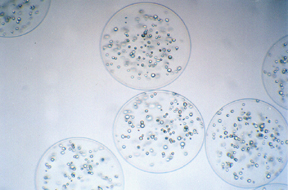
Microcapsule in APA (Alginato-polilisina-alginato) contenenti cellule. I circoli esterni costituiscono la membrana della capsula che racchiude le cellule al suo interno. (foto tratta da: www.mcmaster.ca
 Microcapsule in APA (Alginato-polilisina-alginato) contenenti cellule. I circoli esterni costituiscono la membrana della capsula che racchiude le cellule al suo interno. (foto tratta da: www.mcmaster.ca |
Una forma alternativa di terapia genetica è chiamata terapia somato-genetica. Questa terapia comporta l'incapsulazione (v. avanti) di una linea cellulare che è stata bio-ingegnerizzata per secernere una proteina terapeutica; le cellule microincapsulate verranno poi veicolate in un paziente che è deficiente per quella particolare proteina. In questo modo le microcapsule continueranno a secernere la proteina terapeutica - internamente al paziente - senza attivare il sistema immunitario proprio perché protette dalla microcapsula.
Chi nasce con una mutazione genetica la conserva per tutta la vita, a meno che non si riesca a correggerne il gene responsabile.
Molte malattie sono causate da difetti (mutazioni) di uno o più geni, quindi correggere questi difetti sarebbe sufficiente per ottenere una guarigione definitiva. Questo è il principio generale ma, purtroppo, è più teorico che pratico.
La mappatura del genoma umano ha determinato un contributo essenziale: si conosce la sequenza esatta di tutti i geni presenti nel DNA. Resta da scoprire quale sia la funzione di ogni singolo gene e, anche in questo campo, i progressi sono sempre più rapidi. Trovata la funzione di un certo gene, si può cercare di stabilire quali siano le conseguenze di una sua alterazione funzionale. In effetti questo è ciò che accade: un gene difettoso codifica una proteina anomala che non è in grado di svolgere le sue azioni specifiche e, di conseguenza, l'organismo si ammala. Fin qui è tutto relativamente semplice, le difficoltà arrivano quando si tenta di correggere il gene difettoso (o assente).
Il primo passo consiste nella clonazione del gene: la produzione con tecniche di biologia molecolare di una copia sana del gene difettoso. Questo clone dovrà essere trasferito all'interno delle cellule malate che esprimono il gene difettoso: quelle cellule, cioè, dove il gene mutato è attivo e produce la proteina anomala che causa la disfunzione che si vuole correggere.
Il trasferimento è un passaggio critico e non solo dal punto di vista tecnico. Una volta inserito nella cellula, infatti, il gene si deve esprimere in modo efficace, cioè deve resistere un tempo sufficiente a produrre quantità adeguate della proteina anomala o mancante.
Tecnicamente il trasferimento si può fare in-vivo o ex-vivo. Iniettare il gene direttamente in ogni cellula è un procedimento laborioso e, oltretutto, poco efficace; per questo si utilizzano dei vettori, cioè strutture o organismi, capaci di veicolare il gene all'interno delle cellule bersaglio. I vettori virali sono virus manipolati geneticamente: in questo modo non sono più patogeni ma mantengono la capacità di infettare le cellule dell'ospite inserendovi il loro materiale genetico, compreso il gene da trasferire. Si utilizzano retrovirus, lentivirus, virus adenoassociati e adenovirus a seconda delle cellule bersaglio che si vogliono raggiungere o delle dimensioni del gene che deve essere inoculato.
Esistono anche vettori non virali, come i liposomi: piccole sfere lipidiche che inglobano il pezzo di DNA da trasferire. I liposomi non presentano rischi in termini di sicurezza ma sono meno efficienti dei virus e, soprattutto, meno selettivi nel raggiungere il bersaglio.
Dalla teoria alla pratica gli ostacoli sono ancóra molti. Primo fra tutti l'efficienza del trasferimento, seguìto dal tempo di durata del gene, il quale non è inserito nel DNA, ma rimane libero nella cellula (con i retrovirus si ha un inserimento nel DNA ma il gene non può essere diretto in una posizione specifica). A questo punto, il gene trasferito deve potersi esprimere per un tempo sufficiente a produrre gli effetti terapeutici desiderati: maggiore è questo tempo, minori saranno i trattamenti ripetuti a cui dovrà essere sottoposto il paziente. Le difficoltà, però, non finiscono qui: utilizzando vettori virali, infatti, è sempre presente il rischio che questi mantengano una certa pericolosità (virulenza). Inoltre è sempre possibile che l'organismo del pazienti scateni una reazione immunitaria contro il materiale estraneo che riceve: il gene, la proteina da esso codificata, o il vettore. Una reazione di questo tipo, ovviamente, porterebbe alla distruzione delle cellule geneticamente modificate o alla inattivazione della proteina sana, vanificando il successo della terapia.
Per ora i pazienti guariti con terapia genica sono pochissimi e si tratta di bambini affetti da una grave immunodeficienza ereditaria (SCID = Severe Combined Immune Deficiencies), la prima malattia ad essere affrontata nel 1990 con questa metodica. Questa conclusione non deve scoraggiare perché, a dispetto dei pochi risultati clinici, gli studi in corso in tutto il mondo sono moltissimi. Nonostante il recente stop all'impiego di retrovirus, sottoscritto anche dal Ministero della Salute a causa di eventi avversi verificatisi in Francia ed ai quali i mass media hanno dato ampio risalto, gli esperimenti in vitro e sugli animali spaziano su un'infinità di malattie di cui contribuiscono a chiarire i meccanismi.
Il concetto di microincapsulazione dei farmaci è stato riporato in "Microencapsulation of Multiple Drugs" (MSC-22489), NASA Tech Briefs, Vol. 20, No. 11 (November 1996), page 92. Per riassumere: le microcapsule sono formate come strutture multilaminari, multifase-immiscibili che includono un'alternanza di strati idrofili e idrofobi circondati da membrane polimeriche esterne flessibili e semipermeabili. I rivestimenti sono progettati in modo da permettere la diffusione sostenuta di farmaci bioattivi fuori dalle microcapsule.
I tradizionali sistemi di rilascio dei farmaci sono ottenuti con microcapsule o liposomi, ma entrambi non sono adatti per farmaci che sono chimicamente instabili o che hanno tempi brevi di semivita nelle loro forme attive. Tipicamente, un liposoma o una microcapsula non contiene un farmaco precursore e l'attivatore; per conseguenza, il contenuto della microcapsula non può essere convertito alla forma attiva prima o dopo la somministrazione al paziente. Le microcapsule convenzionali non possono essere dissolte in situ per rilasciare i farmaci attivi sui tessuti bersaglio senza l'utilizzo di una grande quantità di energia che potrebbe avere effetti negativi sui tessuti.
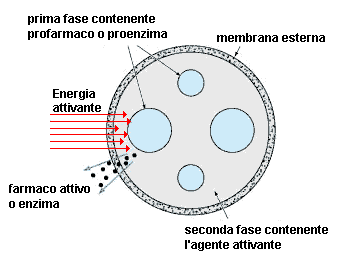 Una microcapsula dovrebbe contenere fasi liquide immiscibili: la prima fase consistente di sferoidi contenenti un profarmaco o un proenzima; la seconda fase un liquido contenente un agente attivante. L'esposizione ad energie elettromagnetiche o ultrasoniche indurrebbe l'attivazione, dopo la quale il farmaco diffonderebbe attraverso la membrana esterna per raggiungere i tessuti circostanti. |
A seconda della profondità del sito bersaglio nel corpo del paziente, l'energia attivante potrebbe essere liberata da un trasduttore esterno, oppure, se necessario, dall'interno mediante l'uso di un catetere esplorativo contenente una fibra ottica, un trasduttore ultrasonico o elettromagnetici, o entrambi. In una variante del concetto base, l'energia di attivazione potrebbe anche essere utilizzata per miscelare le fasi del precursore e dell'attivatore. In un'altra variante, l'agente attivante potrebbe essere contenuto all'interno di una membrana termosensibile che potrebbe essere rotta per rilasciare l'agente attivante. Numerose altre varianti possono essere immaginate.
Lyndon B. Johnson Space Center, Houston, Texas
traduzione: Marcello Guidotti
This work was done by Dennis R. Morrison of Johnson Space Center and Benjamin Mosier of Institute for Research, Inc. For further information, access the Technical Support Package (TSP) free on-line at http://www.nasatech.com/ under the Bio-Medical category.
This invention is owned by NASA, and a patent application has been filed. Inquiries concerning nonexclusive or exclusive license for its commercial development should be addressed to the Patent Counsel, Johnson Space Center, (281) 483-0837. Refer to MSC-22866.
Nel paragrafo precedente abbiamo discusso il concetto di microincapsulazione di farmaci riportato in "Microencapsulation of Multiple Drugs" (MSC-22489), NASA Tech Briefs, Vol. 20, No. 11 (November 1996), page 92.
Più recentemente, un metodo a segnale esterno (external-triggering method) correlato a questo metodo è stato riportato in "In Situ Activation of Microencapsulated Drugs (MSC-22866)," NASA Tech Briefs, Vol. 24, No. 9 (September 2000), page 64.
Una microcapsula del tipo usato in questo metodo è una struttura multistrato che contiene un farmaco in soluzione. Lo strato esterno della microcapsula è una membrana polimerica che è trasparente alla radiazione elettromagnetica ed insolubile nei fluidi acquosi. All'interno della microcapsula, in un compartimento vicino alla membrana esterna, è contenuto un fluido contenente una o più termoparticelle ferromagnetiche.
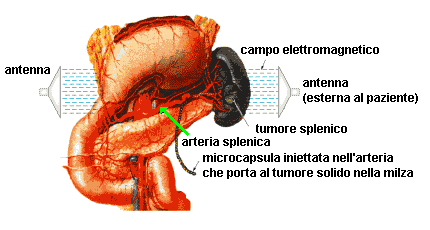 Le microcapsule sono progettate per essere iniettate nelle arterie che conducono a tumori vascolarizzati o altri tessuti bersaglio (v. figura). La membrana esterna polimerica e la termoparticella sono scelti in modo che la temperatura di Curie (temperatura alla quale un materiale perde le proprietà magnetiche. NdT) sia maggiore del punto di fusione del polimero. Quando la microcapsula raggiunge la regione bersaglio, è esposta ad un campo elettromagnetico di adatta frequenza e potenza di flusso per un breve, specifico tempo (minuti), in modo che il campo elettromagnetico riscaldi le termoparticelle. Il calore localizzato della termoparticella produce un foro fondendo la membrana polimerica, così il farmaco viene rilasciato nel tessuto circostante.
Le microcapsule sono progettate per essere iniettate nelle arterie che conducono a tumori vascolarizzati o altri tessuti bersaglio (v. figura). La membrana esterna polimerica e la termoparticella sono scelti in modo che la temperatura di Curie (temperatura alla quale un materiale perde le proprietà magnetiche. NdT) sia maggiore del punto di fusione del polimero. Quando la microcapsula raggiunge la regione bersaglio, è esposta ad un campo elettromagnetico di adatta frequenza e potenza di flusso per un breve, specifico tempo (minuti), in modo che il campo elettromagnetico riscaldi le termoparticelle. Il calore localizzato della termoparticella produce un foro fondendo la membrana polimerica, così il farmaco viene rilasciato nel tessuto circostante.
Affinché le termoparticelle assorbano la radiazione elettromagnetica molto più marcatamente del materiale delle microcapsule e dei tessuti, può essere usato un campo elettromagnetico di potenza relativamente bassa per la liberazione del farmaco. Regolare l'esposizione del campo elettromagnetico non costituisce il problema maggiore: il riscaldamento è automaticamente limitato alla temperatura di Curie perché al di sopra di questa temperatura, le termoparticelle perdono il loro ferromagnetismo e quindi diventano meno assorbenti nei confronti del campo elettromagnetico.
Il materiale ferromagnetico delle termoparticelle può essere formulato con temperature di Curie maggiori di 80 ºC; tuttavia, poiché le termoparticelle sono tipicamente minori di 1 mm, il riscaldamento può essere confinato abbastanza bene da prevenire estesi danni termici al tessuto circostante. Naturalmente, a seconda dell'applicazione, ulteriori vantaggi terapeutici potrebbero essere ottenuti cambiando la frequenza e/o la potenza del campo elettromagnetico, dopo che le microcapsule sono state rotte in modo da ottenere un'ipertermia controllata per migliorare l'efficacia dei farmaci che sono stati rilasciati. In alcune applicazioni, potrebbe essere desiderabile effettuare rilasci multipli dello stesso farmaco o differenti farmaci per l'impiego di miscele iniettabili di microcapsule contenenti particelle ferromagnetiche con differenti temperature di Curie, che potrebbero scattare a tempi differenti, in funzione dell'intensità del campo elettromagnetico e della durata dell'esposizione.
Lyndon B. Johnson Space Center, Houston, Texas
traduzione: Marcello Guidotti
This work was done by Dennis R. Morrison and Benjamin Mosier of Johnson Space Center. For further information, access the Technical Support Package (TSP) free on-line at www.nasatech.com/tsp under the Bio-Medical category.
This invention is owned by NASA, and a patent application has been filed. Inquiries concerning nonexclusive or exclusive license for its commercial development should be addressed to the Patent Counsel, Johnson Space Center, (281) 483-0837. Refer to MSC-22939.
| 4 | |||||||||
Marcello Guidotti, copyright per la traduzione 2003
questa pagina può essere riprodotta su qualsiasi supporto o rivista purché sia citata la fonte e l'indirizzo di questo sito (ai sensi degli artt. 2575 e 2576 cc. Legislazione sul diritto d'autore). Le fotografie sono tratte da siti web e sono, o possono ritenersi, di pubblico dominio purché utilizzate senza fini di lucro. Le immagini di prodotti presenti nel sito hanno unicamente valenza esemplificativa oltre che, eventualmente, illustrare messaggi fuorvianti e non vi è alcun richiamo diretto o indiretto alla loro qualità e/o efficacia il cui controllo è affidato alle autorità regolamentatorie.