liofilizzazione
La liofilizzazione è un processo tecnologico che consente l'eliminazione totale dell'acqua degli alimenti (e farmaci), i quali vengono ridotti in polveri disidratate che per aggiunta della giusta quantità di acqua assumono il gusto e le caratteristiche nutritive (o terapeutiche) che avevano i prodotti prima del trattamento.
Per comprendere i princìpi base di questo processo, occorre far riferimento al diagramma di stato dell'acqua.
diagramma di stato dell'acqua
Lo studio dei cambiamenti di fase dell'acqua è essenziale per comprendere il processo di liofilizzazione. I cambiamenti di fase sono visualizzati tramite il diagramma di stato (o di fase) dell'acqua.
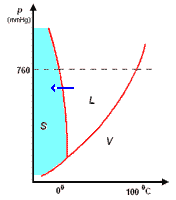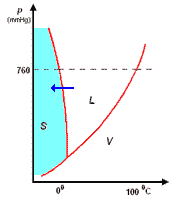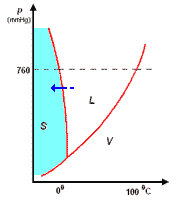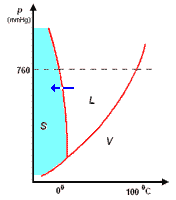
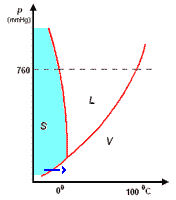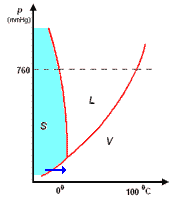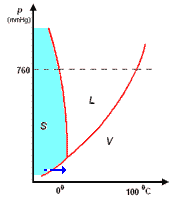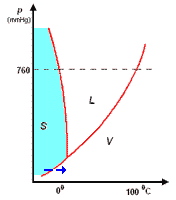
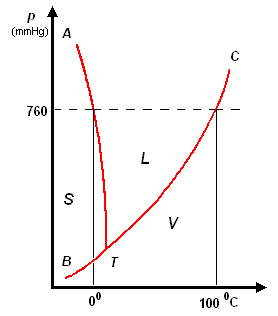 Il diagramma a destra (in scala arbitraria per evidenziare la curvatura di TA verso temperature basse) rappresenta gli stati fisici in cui si trova l'acqua al variare di pressione e temperatura.
Il diagramma a destra (in scala arbitraria per evidenziare la curvatura di TA verso temperature basse) rappresenta gli stati fisici in cui si trova l'acqua al variare di pressione e temperatura.
si distinguono tre zone:
- S = zona di esistenza della fase solida
- L = zona di esistenza della fase liquida
- V = zona di esistenza della fase vapore
e tre curve a delimitazione delle zone di cui sopra:
- BT = curva di coesistenza delle fasi solido-vapore; corrisponde ai processo di sublimazione-brinamento
- TC = curva di coesistenza delle fasi liquido-vapore; corrisponde ai processi di evaporazione-condensazione
- TA = curva di coesistenza delle fasi solido-liquido; corrisponde ai processi di fusione-solidificazione
Infine, l'intersezione in T delle tre curve, rappresenta il punto triplo di coesistenza delle fasi solido-liquido-vapore.
Il punto triplo T è caratterizzato da una unica coppia di valori per p e per t: 4,58 mm Hg e 0,01°C. Questo punto non coincide con il punto di fusione (p = 760 mmHg; t = 0,00°C), poiché questa avviene in presenza di una pressione esterna, p, esercitata dall'aria, come evidenziato nel diagramma.
La curva TA rappresenta così la variazione del punto di fusione sotto l'effetto di una pressione, p, esterna. Ovviamente, sopra al punto critico (temperatura critica 374°C, pressione critica 218 atm) non può esistere equilibrio liquido-vapore L-V, poiché l'acqua esiste solo allo stato vapore.
 L'inclinazione di TA verso sinistra, al crescere della pressione, è una caratteristica dell'acqua, e dà ragione del fatto che aumentando la pressione, p, sul ghiaccio a 0°C, questo passa da fase solida a liquida. Questo fenomeno è sfruttato, per esempio, nel pattinaggio sul ghiaccio. Infatti, la pressione esercitata dalle lame del pattino provocano una fusione superficiale del ghiaccio: il velo d'acqua liquida che si produce, facilita lo scorrimento della lama sul ghiaccio; quando la pressione torna al livello normale, il velo di acqua solidifica nuovamente.
L'inclinazione di TA verso sinistra, al crescere della pressione, è una caratteristica dell'acqua, e dà ragione del fatto che aumentando la pressione, p, sul ghiaccio a 0°C, questo passa da fase solida a liquida. Questo fenomeno è sfruttato, per esempio, nel pattinaggio sul ghiaccio. Infatti, la pressione esercitata dalle lame del pattino provocano una fusione superficiale del ghiaccio: il velo d'acqua liquida che si produce, facilita lo scorrimento della lama sul ghiaccio; quando la pressione torna al livello normale, il velo di acqua solidifica nuovamente.
Il diagramma di stato, è tracciato mediante l'equazione di Clausius-Clapeyron:
dove:
dp/dT = variazione della pressione con la temperatura;
DH = variazione di entalpia associata alla transizione di fase;
T = temperatura assoluta;
DV = variazione di volume associata alla transizione di fase.
il rapporto che compare a primo membro dell'eq. di Clausius-Clapeyron permette di valutare la variazione della pressione con la temperatura. La combinazione delle grandezze a secondo membro, può dare un risultato positivo o negativo, in corrispondenza dei valori assunti da DH e DV (la temperatura assoluta, T, è sempre positiva per definizione). Nel caso dell'acqua, si ha:
- transizione solido
 liquido: il processo richiede calore, quindi DH > 0, contemporaneamente si ha una diminuzione di volume DV < 0;
liquido: il processo richiede calore, quindi DH > 0, contemporaneamente si ha una diminuzione di volume DV < 0;
- transizione solido
 vapore: il processo richiede calore, quindi DH > 0, contemporaneamente si ha un aumento di volume DV > 0;
vapore: il processo richiede calore, quindi DH > 0, contemporaneamente si ha un aumento di volume DV > 0;
- transizione liquido
 vapore: il processo richiede calore, quindi DH > 0, contemporaneamente si ha un aumento di volume DV > 0;
vapore: il processo richiede calore, quindi DH > 0, contemporaneamente si ha un aumento di volume DV > 0;
 E' facile verificare che solo nella prima transizione di fase il termine a secondo membro è negativo e quindi, risultando dp/dT < 0, la pressione di vapore del sistema solido-liquido diminuisce con l'aumentare della temperatura. Questo è l'unico tratto del diagramma di stato dell'acqua con pendenza negativa (caratteristica anche di antimonio, bismuto e gallio) che presenta una diversa inclinazione delle superfici di separazione solido - liquido. Tali sostanze, infatti, durante il processo di solidificazione aumentano il volume specifico.
E' facile verificare che solo nella prima transizione di fase il termine a secondo membro è negativo e quindi, risultando dp/dT < 0, la pressione di vapore del sistema solido-liquido diminuisce con l'aumentare della temperatura. Questo è l'unico tratto del diagramma di stato dell'acqua con pendenza negativa (caratteristica anche di antimonio, bismuto e gallio) che presenta una diversa inclinazione delle superfici di separazione solido - liquido. Tali sostanze, infatti, durante il processo di solidificazione aumentano il volume specifico.
Per integrazione dell'equazione di Clausius-Clapeyron, si ottiene la formula:
che permette di calcolare (per un certo valore di DH), nota la pressione di vapore ad una data temperatura, la pressione di vapore ad una qualsiasi temperatura.
La pressione di vapore (o tensione di vapore) di un liquido aumenta con la temperatura in misura data dall'equazione di Clausius-Clapeyron. Questa relazione assume che si formi un gas ideale via via che un liquido evapora, ed è valida per molte sostanze.
Per i liquidi esiste una temperatura critica oltre la quale lo stato liquido non è stabile. In altre parole, quando una sostanza è riscaldata oltre la temperatura critica, esiste come un fluido: liquido e vapore diventano indistiguibili.
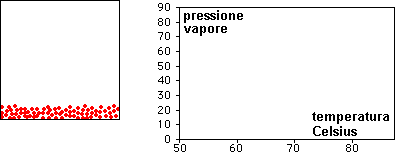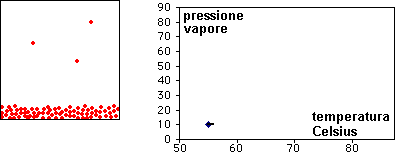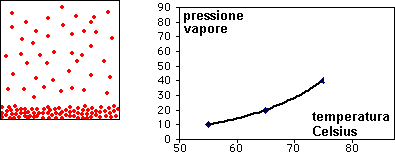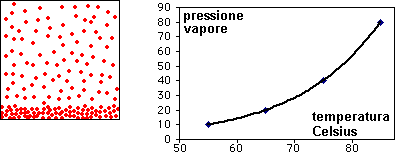
l'animazione mostra l'aumento della pressione della fase gassosa con la temperatura al di sotto della temperatura critica.
|
il processo di liofilizzazione
La liofilizzazione avviene a bassissime temperature ed in condizioni di vuoto spinto in modo che l'acqua contenuta nel prodotto previamente congelato si trasformi in ghiaccio e sublimi passando dallo stato solido a quello di vapore.
La liofilizzazione può definirsi come un processo di disidratazione controllata di prodotti preventivamente congelati che consente di ottenere, oltre a farmaci in polveri liofilizzate ed alimenti conservati, con caratteristiche molto simili a quelle dei prodotti originali, diversi vantaggi, quali:
- lungo periodo di conservazione (superiore ai due anni) anche a temperatura ambiente, se adeguatamente confezionato;
- protezione dagli inquinamenti da parte dei microorganismi;
- ineccepibilità igienica;
- facilità di trasporto e magazzinaggio del prodotto;
- rapida ricostituzione del prodotto non appena il liofilizzato viene posto in presenza dell'acqua;
- conservazione delle caratteristiche del prodotto di partenza (il patrimonio proteico, il contenuto in vitamine, gli elementi minerali ed i lipidi, la cui conservazione serve a garantire la buona digeribilità del prodotto).
Si tratta, in pratica, di congelare il prodotto da trattare ad una temperatura di -30, -40 °C all'interno di recipienti in acciaio inox (rispondenti alle norme igienico sanitarie), i quali, a loro volta, vengono posti all'interno del liostato in cui la pressione viene ridotta ad un valore tale che l'acqua presente nel prodotto precedentemente congelato, possa sublimare sotto vuoto mediante il riscaldamento ad una temperatura di 30° C, lasciando il prodotto essiccato praticamente in maniera completa.
Si ottiene così una massa solida, porosa, friabile, igroscopica, molto solubile nel medesimo solvente, che occupa lo stesso volume della massa congelata iniziale, detta liofilizzato. La ragione principale dello sviluppo di questa tecnologia nel settore farmaceutico è dovuta alla possibilità di realizzare formulazioni stabili nel tempo utilizzando sostanze che si degradano facilmente in soluzione.
Liofilizzato è, per esempio, tutto il cibo consumato sino ad oggi dagli astronauti nello spazio. I liofilizzati conservano le stesse qualità nutrizionali dei prodotti di partenza e vanno reidratati prima del consumo: si tratta di un'operazione pressocché istantanea e l'alimento ricostituito è del tutto simile a quello fresco.
operazioni relative al processo di liofilizzazione
1) fase preparatoria: comprende le operazioni di dissoluzione o sospensione nel solvente delle sostanze attive e dell'eventuale supporto; filtrazione della soluzione (quando necessario con effetto sterilizzante seguìta da immediato trasferimento del filtrato in blocco sterile), ripartizione nei contenitori costituiti generalmente da fiale o flaconi.
Poiché molto spesso la sostanza attiva per ogni contenitore è in quantità troppo piccola (anche pochi mg) ed il volume di soluzione corrispondente sarebbe difficilmente dosabile con precisione, oltre al fatto che alla fine del processo la fiala o il flacone sembrerebbero quasi vuoti, è necessario aggiungere un eccipiente, che sia atossico, privo di qualsiasi attività farmacologica e dia un liofilizzato di bell'aspetto: uno degli eccipienti utilizzati, é il mannitolo.
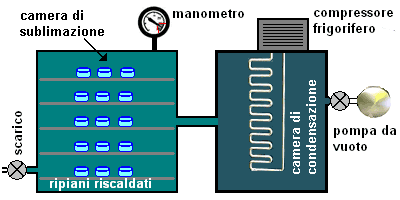
rappresentazione schematica di un'apparecchiatura per liofilizzazione (la figura non è in scala e i dettagli sono incompleti)
|
La soluzione o la sospensione viene congelata mediante raffreddamento rapido |
Il solvente rimasto nel liofilizzato viene eliminato mediante sublimazione |
2) fase di liofilizzazione: comprende:
a) il congelamento della soluzione ripartita, può essere condotto velocemente o lentamente, però generalmente lo si esegue in modo rapido perché in tal modo la formazione di cristalli di ghiaccio si produce simultaneamente in tutte le parti del preparato e si ottengono cristalli piccoli e distribuiti uniformemente: la formazione di strutture cristalline di grandi dimensioni derivanti da un processo di congelamento lento può danneggiare il prodotto da liofilizzare (aspetto particolarmente critico per la struttura cellulare di materiali organici). Nella liofilizzazione industriale il congelamento avviene per raffreddamento. Il materiale può essere congelato nella stessa camera in cui avviene l'essiccamento o al di fuori, in contenitori detti precongelatori o frigocelle, ponendolo su piastre portaprodotto che vengono raffreddate. E' opportuno disporre il materiale su ampia superficie e con spessore ridotto al minimo per facilitare le fasi successive di liofilizzazione.
b) la sublimazione del ghiaccio (o essiccamento), che a sua volta prevede due punti:
- essiccamento primario: una volta congelato omogeneamente in tutte le sue parti, il preparato viene sottoposto all'azione del vuoto per provocarne la sublimazione del solvente. Quando il vuoto raggiunge valori elevati si inizia il riscaldamento. Durante la sublimazione è necessario che il materiale sia perfettamente congelato, in caso contrario si possono verificare fenomeni di fusione della massa con possibilità di alterazione del prodotto. Per questa ragione è necessario conoscere il valore della temperatura alla quale la massa congelata comincia a fondere, onde poter fissare la zona di lavoro più idonea. Sono necessarie due condizioni per avere una continuità nel processo: un continuo apporto di calore alle molecole del congelato e l'evacuazione progressiva del vapore prodotto.
Durante il processo di sublimazione, è necessario fornire calore al prodotto; diversamente, la sua temperatura diminuirebbe fino ad arrestare il processo di essiccamento. Per questa ragione si utilizza un termostato che riscalda i ripiani in modo che possano essere usati per fornire il calore necessario a rimpiazzare l'energia persa con l'evaporazione dell'acqua di sublimazione in modo da mantenere il prodotto a temperatura costante.
L'eliminazione del vapore acqueo (necessaria per impedire che la camera di sublimazione si saturi di vapore acqueo) viene effettuata mediante condensatori (apparecchiature fornite di superfici refrigerate sulle quali il vapore si deposita ricondensandosi direttamente come ghiaccio). La temperatura del condensatore è di circa 20°C inferiore a quella della massa in corso di liofilizzazione, per permettere il passaggio del vapore dalla camera di sublimazione a quella di condensazione in base alla differenza di tensione di vapore del ghiaccio esistente in queste due zone e tenuto conto che in entrambe le camere sono mantenuti gli stessi valori di depressione.
- essiccamento secondario: quando l'ultimo frammento di ghiaccio è scomparso, si può ritenere terminato l'essiccamento primario: ciò si può apprezzare praticamente attraverso il rialzo di temperatura della massa. L'essiccamento secondario è detto anche desorbimento perché si riferisce all'eliminazione del solvente adsorbito tramite un ulteriore innalzamento di temperatura. L'essiccamento secondario serve a ridurre l'umidità dal 7 all'1% circa del peso secco e ad aumentare la conservabilità del prodotto essiccato.
3) fase conclusiva: comprende l'esclusione del vapore acqueo dal sistema mediante ricongelamento e raccolta su di un apposito condensatore, l'apertura della camera di liofilizzazione e la chiusura delle fiale o dei flaconi.
 Il processo di liofilizzazione - mentre il materiale essicca gradualmente - richiede molte ore (anche giorni - nell'animazione a sinistra è schematizzato un processo che dura 8 ore, accelerato 5.000 volte) in quanto l'eccessivo riscaldamento del materiale (per affrettare il processo) può produrre significativi cambiamenti di composizione e struttura. Inoltre, l'accelerazione del processo di sublimazione potrebbe produrre vapor d'acqua in quantità maggiore di quella che viene rimossa per azione della pompa da vuoto. Questo potrebbe parzialmente reidratare il materiale degradandone la qualità.
Il processo di liofilizzazione - mentre il materiale essicca gradualmente - richiede molte ore (anche giorni - nell'animazione a sinistra è schematizzato un processo che dura 8 ore, accelerato 5.000 volte) in quanto l'eccessivo riscaldamento del materiale (per affrettare il processo) può produrre significativi cambiamenti di composizione e struttura. Inoltre, l'accelerazione del processo di sublimazione potrebbe produrre vapor d'acqua in quantità maggiore di quella che viene rimossa per azione della pompa da vuoto. Questo potrebbe parzialmente reidratare il materiale degradandone la qualità.
- fine liofilizzazione: per verificare la fine della liofilizzazione si eseguono due o tre prove di perdita vuoto nella camera dove è posto il prodotto isolandola dal condensatore tramite la chiusura di una valvola intermedia. Se la perdita di vuoto è contenuta e costante si ritiene finita la liofilizzazione.
- chiusura dei contenitori: i prodotti liofilizzati sono altamente igroscopici, quindi è necessario che vengano chiusi in idonei contenitori a tenuta, operando in locali per lo più sterili con umidità relativa molto bassa.
I cibi liofilizzati vengono confezionati, in atmosfera protetta o controllata, con involucri resistenti all'ossigeno e all'umidità, generalmente alluminio e polietilene, ma anche vetro. Si applica a: caffè, the solubile, camomilla solubile, succhi di frutta, frutta esotica, funghi prodotti dietetici e per l'infanzia, farmaci. Quanto più il confezionamento è accurato, tanto più il prodotto può mantenersi integro per anni e anni senza degradarsi finquando è riportato alla sua forma originale con un po' d'acqua.
Le fiale vengono saldate alla fiamma con apposite macchine automatiche. I flaconi vengono inseriti in una macchina che li chiude con il tappo perforabile con l'ago della siringa, in gomma butile (il materiale più idoneo per la sua alta impermeabilità ai vapori d'acqua), inserisce la capsula di alluminio e la ghiera sul collo del flacone. Nella parte centrale, superiormente, la capsula ha uno sportellino a disco, sollevabile al momento dell'uso, per l'introduzione dell'ago.
vantaggi della liofilizzazione
L'uso della liofilizzazione si impone qualora la sostanza da essiccare si alteri nel corso dell'essiccamento con altre metodiche. In tal caso, infatti, le basse temperature utilizzate nella liofilizzazione impediscono cambiamenti chimici che possono verificarsi a carico di numerosi componenti termolabili presenti in farmaci, alimenti, sostanze naturali. La liofilizzazione impedisce anche la formazione di schiuma o bolle in quanto l'essiccamento avviene allo stato solido; ciò è particolarmente importante per le soluzioni proteiche, in cui la formazione di schiuma può comportare denaturazione delle proteine. Inoltre, la liofilizzazione assicura la dispersione permanente del materiale, che si essicca senza subire concentrazione, e forma un solido poroso che si scioglie all'occorrenza con grande rapidità ed efficacia. Un ulteriore vantaggio è che in corso di liofilizzazione le particelle di soluto restano praticamente bloccate nelle posizioni che occupavano prima dell'evaporazione del solvente, evitando quindi effetti di coagulazione. Importantissimo è poi il fatto che la crescita batterica ed i cambiamenti enzimatici non possono aver luogo nel materiale congelato durante liofilizzazione ed i liofili ottenuti sono molto resistenti a tali indesiderabili fenomeni.
 1 1 |
 2 2 |
 3 3 |
 4 4 |
 5 5 |
6 |
 7 7 |
 8 8 |
 9 9 |
 10 10 |
 11 11 |
 12 12 |
 13 13 |
 14 14 |
 15 15 |
 HOME PAGE HOME PAGE |
Marcello Guidotti, copyright 2003-2004
questa pagina può essere riprodotta su qualsiasi supporto o rivista purché sia citata la fonte e l'indirizzo di questo sito (ai sensi degli artt. 2575 e 2576 cc. Legislazione sul diritto d'autore). Le fotografie sono tratte da siti web e sono, o possono ritenersi, di pubblico dominio purché utilizzate senza fini di lucro. Le immagini di prodotti presenti nel sito hanno unicamente valenza esemplificativa oltre che, eventualmente, illustrare messaggi fuorvianti e non vi è alcun richiamo diretto o indiretto alla loro qualità e/o efficacia il cui controllo è affidato alle autorità regolamentatorie.
 Il diagramma a destra (in scala arbitraria per evidenziare la curvatura di TA verso temperature basse) rappresenta gli stati fisici in cui si trova l'acqua al variare di pressione e temperatura.
Il diagramma a destra (in scala arbitraria per evidenziare la curvatura di TA verso temperature basse) rappresenta gli stati fisici in cui si trova l'acqua al variare di pressione e temperatura.
 Il diagramma a destra (in scala arbitraria per evidenziare la curvatura di TA verso temperature basse) rappresenta gli stati fisici in cui si trova l'acqua al variare di pressione e temperatura.
Il diagramma a destra (in scala arbitraria per evidenziare la curvatura di TA verso temperature basse) rappresenta gli stati fisici in cui si trova l'acqua al variare di pressione e temperatura.
 L'inclinazione di TA verso sinistra, al crescere della pressione, è una caratteristica dell'acqua, e dà ragione del fatto che aumentando la pressione, p, sul ghiaccio a 0°C, questo passa da fase solida a liquida. Questo fenomeno è sfruttato, per esempio, nel pattinaggio sul ghiaccio. Infatti, la pressione esercitata dalle lame del pattino provocano una fusione superficiale del ghiaccio: il velo d'acqua liquida che si produce, facilita lo scorrimento della lama sul ghiaccio; quando la pressione torna al livello normale, il velo di acqua solidifica nuovamente.
L'inclinazione di TA verso sinistra, al crescere della pressione, è una caratteristica dell'acqua, e dà ragione del fatto che aumentando la pressione, p, sul ghiaccio a 0°C, questo passa da fase solida a liquida. Questo fenomeno è sfruttato, per esempio, nel pattinaggio sul ghiaccio. Infatti, la pressione esercitata dalle lame del pattino provocano una fusione superficiale del ghiaccio: il velo d'acqua liquida che si produce, facilita lo scorrimento della lama sul ghiaccio; quando la pressione torna al livello normale, il velo di acqua solidifica nuovamente.
 E' facile verificare che solo nella prima transizione di fase il termine a secondo membro è negativo e quindi, risultando dp/dT < 0, la pressione di vapore del sistema solido-liquido diminuisce con l'aumentare della temperatura. Questo è l'unico tratto del diagramma di stato dell'acqua con pendenza negativa (caratteristica anche di antimonio, bismuto e gallio) che presenta una diversa inclinazione delle superfici di separazione solido - liquido. Tali sostanze, infatti, durante il processo di solidificazione aumentano il volume specifico.
E' facile verificare che solo nella prima transizione di fase il termine a secondo membro è negativo e quindi, risultando dp/dT < 0, la pressione di vapore del sistema solido-liquido diminuisce con l'aumentare della temperatura. Questo è l'unico tratto del diagramma di stato dell'acqua con pendenza negativa (caratteristica anche di antimonio, bismuto e gallio) che presenta una diversa inclinazione delle superfici di separazione solido - liquido. Tali sostanze, infatti, durante il processo di solidificazione aumentano il volume specifico.
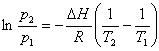




 Il processo di liofilizzazione - mentre il materiale essicca gradualmente - richiede molte ore (anche giorni - nell'animazione a sinistra è schematizzato un processo che dura 8 ore, accelerato 5.000 volte) in quanto l'eccessivo riscaldamento del materiale (per affrettare il processo) può produrre significativi cambiamenti di composizione e struttura. Inoltre, l'accelerazione del processo di sublimazione potrebbe produrre vapor d'acqua in quantità maggiore di quella che viene rimossa per azione della pompa da vuoto. Questo potrebbe parzialmente reidratare il materiale degradandone la qualità.
Il processo di liofilizzazione - mentre il materiale essicca gradualmente - richiede molte ore (anche giorni - nell'animazione a sinistra è schematizzato un processo che dura 8 ore, accelerato 5.000 volte) in quanto l'eccessivo riscaldamento del materiale (per affrettare il processo) può produrre significativi cambiamenti di composizione e struttura. Inoltre, l'accelerazione del processo di sublimazione potrebbe produrre vapor d'acqua in quantità maggiore di quella che viene rimossa per azione della pompa da vuoto. Questo potrebbe parzialmente reidratare il materiale degradandone la qualità.