
1. Si intendono per prodotti cosmetici le sostanze e le preparazioni, diverse dai medicinali, destinate ad essere applicate sulle superfici esterne del corpo umano (epidermide, sistema pilifero e capelli, unghie, labbra, organi genitali esterni) oppure sui denti e sulle mucose allo scopo, esclusivo o prevalente, di pulirli, profumarli, modificarne l'aspetto, correggere gli odori corporei, proteggerli o mantenerli in buono stato.

2. I prodotti cosmetici non hanno finalità terapeutica e non possono vantare attività terapeutiche.
3. Sono in particolare prodotti cosmetici, ai sensi dei commi precedenti, i prodotti che figurano nell'allegato I annesso alla presente legge.
I prodotti cosmetici vengono suddivisi in cosmetici generici e cosmetici medicinali e sono soggetti a normative di legge diverse regolamentate da distinti elenchi riportando gli ingredienti d’uso in cosmetica.
a) il nome o la ragione sociale e la sede legale del produttore o del responsabile dell'immissione sul mercato del prodotto cosmetico stabilito all'interno dell'Unione europea. Tali indicazioni possono essere abbreviate purché sia possibile l'identificazione dell'impresa;
b) il contenuto nominale al momento del confezionamento, espresso in misure legali del sistema metrico, per prodotti aventi peso o volume netto superiore o uguale, rispettivamente, a 5 grammi o 5 millilitri. L'indicazione non è obbligatoria per i campioni gratuiti, per le monodosi, nonché per gli imballaggi preconfezionati solitamente commercializzati per insieme di pezzi, per i quali l'indicazione del peso e del volume non ha rilevanza pratica; in quest'ultimo caso sull'imballaggio deve essere menzionato il numero dei pezzi, quando lo stesso non possa essere agevolmente determinato dall'esterno. In aggiunta alle indicazioni in misure legali del sistema metrico, il contenuto nominale può essere espresso anche in unità di misura diverse, purché con caratteri di dimensioni non superiori a quelle delle misure legali;
c) la data di durata minima del prodotto cosmetico, che corrisponde a quella alla quale tale prodotto, opportunamente conservato, continua a soddisfare la sua funzione iniziale e rimane in particolare conforme alle disposizioni di cui al comma 1 dell'articolo 7. Essa è indicata con la dicitura "da usare preferibilmente entro ..." seguita dalla data stessa, oppure dall'indicazione del punto della confezione su cui questa figura. La data è indicata in modo chiaro e si compone, nell'ordine, del mese e dell'anno oppure del giorno, del mese e dell'anno. Se necessario, tale indicazione è completata precisando anche le condizioni da rispettare per garantire la durata indicata. L'indicazione della data di durata minima non è obbligatoria per i prodotti cosmetici che abbiano una durata minima superiore ai trenta mesi. Per tali prodotti è riportata un'indicazione relativa al periodo di tempo in cui il prodotto, una volta aperto, può essere utilizzato senza effetti nocivi per il consumatore. Tale informazione è indicata tramite il simbolo raffigurato nell'allegato VI-bis, seguito dall'indicazione del numero dei mesi, o degli anni, o degli anni e dei mesi, in cui il prodotto, una volta aperto, può essere utilizzato senza effetti nocivi per il consumatore;
d) le precauzioni particolari per l'impiego, segnatamente quelle indicate nelle colonne degli allegati III e V intitolate "Modalità di impiego e avvertenze da indicare obbligatoriamente sull'etichetta", le quali debbono figurare sul condizionamento primario e sull'imballaggio secondario nonché le eventuali indicazioni concernenti precauzioni particolari da osservare per i prodotti cosmetici di uso professionale, in particolare quelli destinati ai parrucchieri. In caso di impossibilità pratica, un foglio di istruzioni, una fascetta o un cartellino allegati devono riportare tali indicazioni, alle quali il consumatore deve essere rinviato mediante un'indicazione abbreviata o mediante il simbolo raffigurato nell'allegato VI, che devono comparire sul condizionamento primario e sull'imballaggio secondario;
e) il numero del lotto di fabbricazione o il riferimento che consenta la identificazione della fabbricazione; tuttavia, in caso di impossibilità pratica dovuta alle ridotte dimensioni del prodotto cosmetico, tale menzione può figurare soltanto sull'imballaggio secondario di detti prodotti;
f) il Paese d'origine per i prodotti fabbricati in Paesi non membri dell'Unione europea;
g) la funzione del prodotto, salvo se risulta dalla presentazione dello stesso;
h) l'elenco degli ingredienti nell'ordine decrescente di peso al momento dell'incorporazione. Tale elenco viene preceduto dal termine "ingredienti" o "ingredients". In caso di impossibilità pratica, un foglio di istruzioni, un'etichetta, una fascetta o un cartellino allegato devono riportare gli ingredienti, ai quali il consumatore deve essere rinviato mediante un'indicazione abbreviata o mediante il simbolo di cui all'allegato VI, che devono comparire sulla confezione. Tuttavia, non sono considerati ingredienti:
1) le impurezze contenute nelle materie prime utilizzate;
2) le sostanze tecniche secondarie utilizzate nella fabbricazione ma che non compaiono nella composizione del prodotto finito;
3) le sostanze utilizzate nei quantitativi strettamente necessari come solventi o come vettori di composti odoranti e aromatizzanti.
2. I composti odoranti e aromatizzanti e le loro materie prime devono essere indicati con il termine "profumo" o "parfum" e "aroma" . Tuttavia, la presenza di sostanze la cui indicazione è prescritta ai sensi della colonna "Altre limitazioni e prescrizioni" dell'allegato III figurano nell'elenco indipendentemente dalla funzione che hanno nel prodotto.
3. Gli ingredienti in concentrazione inferiore all'1 per cento possono essere menzionati in ordine sparso dopo quelli in concentrazione superiore all'1 per cento.
4. I coloranti possono essere indicati in ordine sparso dopo gli altri ingredienti, conformemente al numero colour index o alla denominazione di cui all'allegato IV. Per i prodotti cosmetici da trucco, ivi compresi quelli per le unghie e per i capelli, immessi sul mercato in varie sfumature di colore, può essere menzionato l'insieme dei coloranti utilizzati nella gamma a condizione di aggiungervi le parole "può contenere" o il simbolo "+/-".
5. Gli ingredienti devono essere dichiarati con la nomenclatura comune prevista dall'inventario europeo degli ingredienti cosmetici di cui alla decisione della Commissione delle Comunità europee 96/335/CE, dell'8 maggio 1996, pubblicata nella Gazzetta Ufficiale delle Comunità europee n. 132 del 1° giugno 1996, e sue modificazioni, ovvero, se gli ingredienti non sono compresi in taleinventario, con una delle altre denominazioni previste dal predetto inventario.
6. Qualora, a causa delle dimensioni o della forma, sia impossibile far figurare le indicazioni di cui alle lettere d) ed h) del comma 1 su un foglio di istruzioni allegato, dette indicazioni devono figurare su una fascetta o un cartellino fissati al prodotto cosmetico.
7. Qualora, nel caso del sapone e delle perle da bagno, o a causa delle dimensioni o della forma del prodotto, sia impossibile far figurare le indicazioni di cui alla lettera h) del comma 1 su una fascetta o un cartellino fissati sul prodotto, oppure su un foglio di istruzioni allegato, dette indicazioni devono figurare su un avviso collocato in prossimità del contenitore nel quale il prodotto cosmetico è esposto per la vendita.
8. Per i cosmetici confezionati dal venditore su richiesta dell'acquirente o preconfezionati in vista della loro vendita immediata, sempre nel rispetto delle disposizioni di cui all'articolo 10, le diciture di cui ai commi 1, 2, 3 e 4 devono essere riportate almeno sull'imballaggio secondario, a cura del venditore.
9. I cosmetici posti in vendita allo stato sfuso devono essere venduti unitamente ad un foglio riportante le indicazioni di cui ai commi 1, 2, 3 e 4.
9-bis. Il fabbricante o il responsabile dell'immissione del prodotto cosmetico sul mercato comunitario può indicare, sulla confezione del prodotto o su qualsiasi documento, foglio di istruzioni, etichetta, fascetta o cartellino che accompagna o si riferisce a tale prodotto, che quest'ultimo è stato sviluppato senza fare ricorso alla sperimentazione animale, solo a condizione che il fabbricante e i suoi fornitori non abbiano effettuato o commissionato sperimentazioni animali sul prodotto finito, sul suo prototipo, nè su alcun suo ingrediente e che non abbiano usato ingredienti sottoposti da terzi a sperimentazioni animali al fine di ottenere nuovi prodotti cosmetici.
10. Sul condizionamento primario e sull'imballaggio secondario dei prodotti cosmetici è consentito l'uso di espressioni che facciano riferimento ad acque minerali, a sorgenti o fanghi termali, soltanto se i prodotti stessi contengono sali minerali o fango maturato in acqua termale o fitoestratti da vegetazione termale, provenienti dagli stabilimenti termali di cui all'articolo 14, lettera a), del regio decreto 28 settembre 1919, n. 1924, o da stabilimenti termali esteri riconosciuti dalle competenti autorità nazionali.
[... omissis...]
1. Il produttore o il suo mandatario o il soggetto per conto del quale è fabbricato un prodotto cosmetico, o il responsabile dell'immissione sul mercato comunitario di un prodotto cosmetico importato che, per motivi di riservatezza commerciale, intende ottenere la non iscrizione di uno o più ingredienti di un prodotto cosmetico nell'elenco di cui all'articolo 8, comma 1, lettera h), presenta a tal fine una domanda presso il Ministero della sanità - Dipartimento per la valutazione dei medicinali e la farmacovigilanza, d'ora in avanti indicato come "Ministero".
2. La domanda di cui al comma 1 deve contenere:
a) il nome o la ragione sociale e l'indirizzo o la sede legale del richiedente;
b) una precisa identificazione degli ingredienti per i quali è richiesta la riservatezza, tramite:
1) i numeri CAS (Chemical Abstracts Service), EINECS (European Inventory of Existing Commercial Chemical Substances) e Colour index, la denominazione chimica, la denominazione IUPAC (International Union of Pure and Applied Chemistry), la denominazione INCI, la denominazione della Farmacopea europea, la denominazione comune internazionale dell'OMS e la denominazione della nomenclatura comune prevista dall'inventario europeo degli ingredienti cosmetici, se esistono;
2) la denominazione ELINCS (European List of Notified Chemical Substances) e il numero ufficiale che è stato attribuito all'ingrediente in caso di notificazione sulla base della direttiva 67/548/CEE del Consiglio, nonché l'indicazione del riconoscimento o del rifiuto di riconoscimento della riservatezza sulla base dell'articolo 19 della stessa direttiva;
3) il nome della sostanza costitutiva di base, il nome della parte di pianta o di animale utilizzata, il nome dei componenti l'ingrediente, quali i solventi, nel caso in cui nomi e numeri di cui ai numeri 1) e 2) non esistano, ad esempio quando si tratta di ingredienti di origine naturale;
c) la valutazione della sicurezza per la salute umana dell'ingrediente utilizzato nel prodotto finito, tenendo conto del profilo tossicologico, della struttura chimica e del livello di esposizione dell'ingrediente, secondo le condizioni di cui all'articolo 10-ter;
d) il prevedibile uso dell'ingrediente ed in particolare le varie categorie di prodotti in cui sarà utilizzato;
e) una documentazione dettagliata dei motivi per i quali è richiesta, a titolo eccezionale, la riservatezza come, ad esempio:
1) il fatto che l'identità dell'ingrediente o la sua funzione nel prodotto cosmetico da immettere in commercio non è descritta nella letteratura o è sconosciuta alle regole dell'arte;
2) il fatto che l'informazione non è ancora di dominio pubblico, pur essendo già depositata una richiesta di brevetto per l'ingrediente o per la sua utilizzazione;
3) il fatto che se l'informazione fosse nota l'ingrediente o il procedimento sarebbero facilmente riproducibili, con pregiudizio del richiedente;
f) il nome di ciascun prodotto che conterrà l'ingrediente, se è noto, e, se si prevede di utilizzare diverse denominazioni sul mercato comunitario, l'elenco delle stesse. Se il nome del prodotto non è ancora noto, la comunicazione potrà essere effettuata successivamente, ma comunque almeno quindici giorni prima dell'immissione sul mercato del prodotto stesso. Se l'ingrediente è utilizzato in una pluralità di prodotti della stessa impresa, è sufficiente una sola domanda, purché tali prodotti siano chiaramente indicati al Ministero;
g) una dichiarazione che precisi se una domanda è stata presentata all'autorità competente di un altro Stato membro, nonché informazioni in merito al seguito dato a tale domanda.
3. Dopo avere ricevuto una domanda di riservatezza conforme al disposto del comma 2, il Ministero la esamina entro un termine non superiore a centoventi giorni e informa per iscritto il richiedente sul suo esito. In caso di accoglimento, il Ministero comunica inoltre al richiedente il numero di registrazione attribuito all'ingrediente secondo le modalità di cui all'allegato VII. Tuttavia, per motivi eccezionali, il Ministero può informare per iscritto il richiedente circa la necessità di un periodo di tempo supplementare, in ogni caso non superiore a sessanta giorni, per esaminare la domanda.
4. Il rifiuto del riconoscimento della riservatezza deve essere motivato e vengono chiaramente indicati al richiedente i mezzi di ricorso ed i relativi termini di presentazione.
5. Il numero di registrazione di cui al comma 3 sostituisce la denominazione dell'ingrediente nell'elenco di cui all'articolo 8, comma 1, lettera h).
6. Ogni modificazione delle informazioni fornite secondo il comma 2 deve essere comunicata quanto prima al Ministero e comunque almeno quindici giorni prima dell'immissione in commercio del prodotto per il quale è stata concessa la riservatezza di un ingrediente. La modifica della denominazione dei prodotti cosmetici in cui è contenuto l'ingrediente viene comunicata al Ministero almeno quindici giorni prima dell'immissione sul mercato dei prodotti sotto tale nuova denominazione.
7. Tenuto conto delle modificazioni di cui al comma 6 o nel caso in cui nuovi elementi, in particolare motivi imperativi di sanità pubblica, lo impongano, il Ministero può revocare il riconoscimento della riservatezza; in tal caso informa il richiedente della decisione entro i termini e secondo le modalità di cui al comma 4.
8. Il riconoscimento della riservatezza ha una durata di validità di cinque anni. Tuttavia il destinatario della decisione, se ritiene che sussistano motivi eccezionali che giustificano una proroga di tale durata, può presentare una domanda motivata presso il Ministero che si pronuncia sulla stessa entro i termini e secondo le modalità di cui ai commi 3 e 4. La proroga non può superare i tre anni.
[... omissis...
divieti (Art. 9)
1. È vietato usare nell'etichettatura, nella presentazione alla vendita e nella pubblicità dei prodotti cosmetici testi, denominazioni, marchi, immagini ed altri segni figurativi o meno, che attribuiscano a tali prodotti caratteristiche non previste dall'articolo 1.
[... omissis...]
3. Nei messaggi pubblicitari autorizzati con licenze di pubblicità sanitarie rilasciate dal Ministero della sanità, non potranno essere attribuite finalità cosmetiche a prodotti registrati come presìdi medico-chirurgici o come specialità medicinali.
2. Il direttore tecnico svolge la sua attività con un rapporto di lavoro che può essere di tipo professionale.
3. Il direttore tecnico è responsabile della corretta esecuzione delle operazioni di produzione e confezionamento conformemente alle buone pratiche di fabbricazione, di cui al comma 4 o, in mancanza, alle disposizioni del decreto del Ministro della sanità 9 luglio 1987, n. 328, e successive modificazioni e integrazioni, senza pregiudizio della responsabilità dell'imprenditore
3-bis. L'importazione dei prodotti cosmetici da Paesi non membri dell'Unione europea deve avvenire sotto la responsabilità di un esperto avente i requisiti di cui ai commi 1 e 2, il quale è tenuto a valutare il metodo di fabbricazione utilizzato per i prodotti stessi .
[... omissis...]
5. Chiunque intenda produrre o confezionare in proprio e per conto terzi i prodotti di cui all'articolo 1 deve darne comunicazione scritta almeno trenta giorni prima dell'inizio della attività al Ministero della sanità e alla regione.
[... omissis...]
I Paesi dell'Unione, tra cui Francia, Germania, Italia, Regno Unito, Spagna, ed Olanda che rappresentano la quasi totalità del mercato cosmetico nell’UE, hanno ufficialmente interpretato il termine "immissione sul mercato" come la prima messa a disposizione del prodotto (a titolo gratuito o oneroso) in vista della distribuzione e/o utilizzazione sul mercato comunitario. Tale interpretazione è pienamente conforme ai principi affermati nelle direttive cosiddette del nuovo approccio ed in esito ad essa è lecito concludere che la messa a disposizione per il commercio possa coincidere con l’invio dei prodotti al (proprio) magazzino in vista della successiva distribuzione.
E' indubbio come il legislatore comunitario e quello nazionale abbiano previsto che i cosmetici immessi precedentemente (rispetto all'11 marzo 2005) sul mercato possano continuare ad essere ceduti al consumatore fino a totale esaurimento delle scorte. Non vi sono quindi elementi normativi per supportare il ritiro dal mercato dei cosmetici non conformi alle nuove norme, a condizione che siano conformi alle previgenti e che siano stati immessi in commercio entro il 10 marzo 2005.
In tale contesto appare legittimo che, per un certo periodo di tempo, si possano trovare sugli scaffali di tutta l’Unione Europea cosmetici conformi e "difformi" alla Direttiva 2003/15/CE.
Ancora, giova rammentare che in esito a quanto convenuto fra la Commissione UE, le Autorità competenti nazionali, le associazioni consumatori ed industria cosmetica nella riunione dell’Ad Hoc Working Party Cosmetics del 19 aprile 2004, anche in tempo successivo all’11 marzo 2005, potranno essere immessi sul mercato cosmetici privi dell'indicazione del PaO in quanto appartenenti alle categorie che possono essere esentate.
allergeni: sono state individuate 26 sostanze, sintetiche e naturali, particolarmente allergizzanti: per facilitare la scelta di coloro che possono essere allergici ad una o più di esse, dovranno essere indicate in etichetta quando entrano nella composizione del cosmetico oltre una certa concentrazione. Si tratta di sostanze presenti soprattutto nelle fragranze (es. oli essenziali) che vengono impiegate nei profumi utilizzati in molti prodotti cosmetici. Questa informazione permetterà anche ai dermatologi di essere agevolati nell'identificazione degli allergeni, in quanto potranno includere queste 26 sostanze nei test allergologici condotti a fini diagnostici.
informazioni al consumatore: la nuova normativa promuove una maggiore trasparenza per una migliore informazione al pubblico. Infatti, il consumatore può richiedere alle aziende produttrici l'elenco completo degli ingredienti che compongono un cosmetico, nonché informazioni sugli eventuali "effetti indesiderabili" di un determinato prodotto, che siano stati segnalati da altri consumatori. Per assicurare l'accesso a queste informazioni, le aziende devono indicare sulle etichette la ragione sociale che consenta al consumatore di contattare il produttore o il responsabile dell'immissione del prodotto sul mercato.
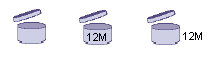 L'indicazione in etichetta del Periodo Post-Apertura ha lo scopo di fornire al consumatore informazioni sulla stabilità del cosmetico ed è indicato da un nuovo simbolo (rappresentato da un barattolo di crema aperto, v. simbolo a sx) che viene apposto sia sul contenitore vero e proprio che sul confezionamento esterno. All'interno o accanto al simbolo è riportato il periodo di tempo (espresso in mesi seguito dalla lettera M) entro il quale il prodotto deve essere utilizzato a partire dalla prima apertura. Il simbolo del PaO sarà presente sull'etichetta di tutti i prodotti cosmetici, ad eccezione di:
L'indicazione in etichetta del Periodo Post-Apertura ha lo scopo di fornire al consumatore informazioni sulla stabilità del cosmetico ed è indicato da un nuovo simbolo (rappresentato da un barattolo di crema aperto, v. simbolo a sx) che viene apposto sia sul contenitore vero e proprio che sul confezionamento esterno. All'interno o accanto al simbolo è riportato il periodo di tempo (espresso in mesi seguito dalla lettera M) entro il quale il prodotto deve essere utilizzato a partire dalla prima apertura. Il simbolo del PaO sarà presente sull'etichetta di tutti i prodotti cosmetici, ad eccezione di:
Per chiarire il significato e l'interpretazione del periodo post-apertura, è necessario precisare che:

 E' conforme alla normativa scrivere effetto lifting... |
Nelle forme ammesse di pubblicità è comunque limitato l'uso dei termini e delle espressioni secondo le indicazioni previste per i prodotti cosmetici dalla circolare del Ministro della Sanità n. 66 del 11.8.1980 (oramai considerata obsoleta e comunque con unico valore indicativo).
allunga-ciglia: soltanto se viene chiarito che l'azione è di tipo meccanico e non biologico.
antiarrossamento: soltanto se chiarito con espressioni del tipo "atto a prevenire l'arrossamento della pelle provocato da agenti esterni".
anticellulite: il termine è improprio e comunque sconsigliabile. Se utilizzato, deve essere adeguatamente caratterizzato in senso cosmetico.
antiocchiaie: soltanto se risulta chiaramente dal contesto che il termine è riferito a prodotto cosmetico adatto a coprire o attenuare l'aspetto inestetico conseguente alle cosiddette occhiaie.
antismagliature: soltanto se dal contesto risulta chiaro che il prodotto non si propone la finalità di eliminare le smagliature formatesi nella pelle, ma quella di coprirle o, tutt'al più, di contribuire nel contrastare la formazione di ulteriori smagliature.
altri termini: Adipo Cinetico, Anallergeno, Anallergico (Il termine è inaccettabile non essendovi sostanze sicuramente non allergiche per tutti i soggetti), Antiacne, Antiallergico, Anticarie, Anticopperosa o anticouperose (Il termine non è cosmetico e va sostituito con un'altra definizione esplicativa quale "preparato coprente o trattamento cosmetico atto a modificare l'aspetto estetico della pelle con pigmentazione di tipo efelidi"), Antimacchie (Il termine è equivoco. va sostituito con altra definizione esplicativa quale "preparato o trattamento cosmetico atto a migliorare o attenuare l'aspetto antiestetico delle macchie della pelle"), Antiseborroico (Il termine è equivoco. Va sostituito con espressione quale "atto a mascherare o eliminare temporaneamente l'untuosità della cute"), Ipoallergico (Il termine appare inopportuno. Può essere, invece, specificato che il prodotto, scientificamente controllato, non ha dato luogo ad allergie in un determinato numero di soggetti), Rassodante del seno (E' equivoco il riferimento a una parte del corpo, dal momento che il cosmetico può agire solo sull'epidermide), Vitaminizzante.
Allo stato attuale, il laureato in Scienza e Tecnologia dei Prodotti Erboristici non può preparare cosmetici; tuttavia, il comma 2 art. 10 precisa che "il direttore tecnico svolge la sua attività con un rapporto di lavoro che può essere di tipo professionale". Questo significa che il titolare di un'erboristeria può preparare cosmetici purché vi sia un responsabile della loro corretta produzione. Ove si verifichi questa circostanza, si deve tener conto che l'erborista ed il direttore tecnico sono entrambi responsabili della corretta preparazione del cosmetico.
| 9 | |||||||||||||||
Marcello Guidotti, copyright 2005-2006
questa pagina può essere riprodotta su qualsiasi supporto o rivista purché sia citata la fonte e l'indirizzo di questo sito (ai sensi degli artt. 2575 e 2576 cc. Legislazione sul diritto d'autore). Le fotografie sono tratte da siti web e sono, o possono ritenersi, di pubblico dominio purché utilizzate senza fini di lucro. Le fotografie sono tratte da siti web e sono, o possono ritenersi, di pubblico dominio purché utilizzate senza fini di lucro. Le immagini di prodotti presenti nel sito hanno unicamente valenza esemplificativa oltre che, eventualmente, illustrare messaggi fuorvianti e non vi è alcun richiamo diretto o indiretto alla loro qualità e/o efficacia il cui controllo è affidato alle autorità regolamentatorie.