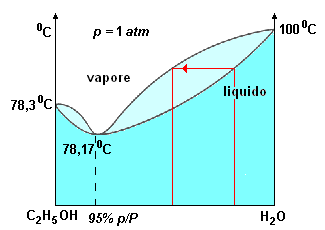
la distillazione frazionata a partire da una soluzione con concentrazione di alcol al 95% p/P è impossibile in quanto la miscela bolle ad una temperatura inferiore a quella dell'alcol puro.
 la distillazione frazionata a partire da una soluzione con concentrazione di alcol al 95% p/P è impossibile in quanto la miscela bolle ad una temperatura inferiore a quella dell'alcol puro. |
Il diagramma isobarico a destra si riferisce ad una soluzione acqua-alcol. Miscele a sinistra di 11,8 (78,17 ºC) liberano un vapore di composizione spostata verso destra, mentre le miscele a destra di 11,8 liberano un vapore di composizione spostata verso sinistra. Questo significa che sottoponendo (come avviene nella pratica) a distillazione frazionata miscele di alcol e acqua contenenti più di 11,8 moli di acqua, nelle prime frazioni del distillato passa la miscela a punto di ebollizione minima, cioè alcol a 95% in peso (questo avviene anche con miscele alcoliche diluite in quanto all'interno della soluzione, è sempre possibile formare l'azeotropo), mentre nella caldaia aumenta la concentrazione di acqua; successivamente distillano miscele a concentrazione alcolica inferiore al 95%.
Al contrario, distillando (operazione non applicata in pratica) miscele contenenti meno di 11,8 moli di acqua, passa nel distillato alcol a 95% mentre nella caldaia aumenta la concentrazione di alcol fino a quando rimane alcol assoluto.
Da quanto discusso, si comprende come per semplice distillazione frazionata di soluzioni diluite di alcol alla pressione atmosferica non è possibile ottenere alcol a concentrazione superiore a 95%. Per togliere la quantità di acqua residua, si può distillare su calce viva.
Una miscela di acqua e alcol etilico, in cui l'alcol è presente in concentrazione p/P = 94,6% e l'acqua p/P = 5,4% presenta un azeotropo con punto di ebollizione 78,15 ºC, cioé 0,15 gradi inferiore al punto di ebollizione dell'alcol (78,30 ºC). Questo significa che l'alcol assoluto non può essere ottenuto distillando una soluzione alcolica con concentrazione p/P = 94,6%
Il seguente programma JavaScript permette di calcolare la temperatura di ebollizione dell'alcol, dell'acqua e del loro azeotropo al variare della temperatura. Si faccia attenzione che la composizione dell'azeotropo è indipendente dalla sua temperatura.
L'alcol assoluto viene ottenuto ricorrendo ad un azeotropo ternario (con punto di ebollizione 64,9 ºC), risultante da una miscela composta da: 7,5% di acqua, 18,5% di alcol e 74% di benzene.
Così, per es., aggiungendo 74 g di benzene ad una miscela contenente 150 g di alcol al 95% (142.5 g alcol, 7.5 g acqua), si ottiene la distillazione di un azeotropo ternario che alla temperatura di 64,9 ºC, è una miscela composta da 74 g di benzene, 18.5 g di alcol e 7.5 g di acqua. In questo modo, è stata eliminata tutta l'acqua e sono rimasti (142,5 - 18,5) = 124 g di alcol anidro puro. In pratica si opera aggiungendo un piccolo eccesso di benzene, che viene poi allontanato come azeotropo binario alcol-benzene che bolle a 68,3 ºC (temperatura superiore alla temperatura di ebollizione dell'alcol).
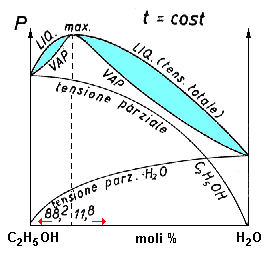 diagramma isotermo di una soluzione acqua-alcol. Si faccia attenzione: in questo caso, le curve superiori (delle asole) sono quelle del liquido in quanto è questo che ha la tensione di vapore maggiore. |
| alcol etilico 78,3 °C | minimo 66,7 °C con composizione 46 EtOH + 54 benzene |
| benzene 79,5 °C | |
| alcol propilico 97,4 °C | minimo 87,7 °C con composizione 43,3 alcol propilico + 54 benzene |
| acqua 100 °C |
Altri esempi di minimo punto di ebollizione sono caratteristici di coppie di liquidi per i quali sono riportate le composizioni molari della miscela a minimo punto di ebollizione ed alla pressione di un'atmosfera.
Un'altra fonte di alcol si ottiene indirettamnete dal processo Weizmann (dal nome del suo scopritore, Chaim W.) per la fermentazione batterica dell'amido, con il quale si ottiene una miscela formata da 60% di alcol n-butilico, 10% di alcol etilico e 30% di acetone.
L'alcol etilico è presente nelle bevande alcoliche preparate per fermentazione a partire da una grande varietà di vegetali. Il tipo di bevanda ottenuto dipende dal materiale usato per la fermentazione (segale o frumento, uva o bacche di sambuco, polpa di cactus o soffioni), dalle condizioni di fermentazione (ad esempio se l'anidride carbonica viene trattenuta o meno nel liquido fermentato) e dalle operazioni eseguite dopo la fermentazione (se il liquido viene distillato o no). L'aroma particolare della bevanda ottenuto non è quindi dovuto all'alcol etilico, ma ad altre sostanze presenti nella materia prima o appositamente aggiunte. In medicina l'alcol etilico è classificato tra gli ipnotici ed è meno tossico di altri alcoli.
L'alcol etilico risente di un problema particolare legato al suo duplice uso come bevanda soggetta a tassazione, e come importante prodotto chimico industriale. Il problema della sua fornitura in forma non bevibile alle industrie chimiche è risolto con l'addizione di un denaturante: una sostanza o miscela di sostanze che lo rende di gusto sgradevole o addirittura velenoso. Il metanolo e la benzina "avio" sono, ad esempio, due fra i più comuni denaturanti legali. Quando è necessario, si può avere dell'alcol puro non denaturato per usi chimici, ma il suo utilizzo è strettamente regolamentato.
Ad eccezione delle bevande alcoliche, quasi tutto l'alcol etilico usato è una miscela costituita da 95% di alcol e 5% di acqua, il cosiddetto alcol a 95%. Esiste anche l'alcol puro (o assoluto), ma è molto più costoso e viene usato solo quando è strettamente necessario.
Come è noto, la separazione di una miscela per distillazione avviene in quanto il vapore ha una composizione diversa da quella del liquido dal quale distilla, ed è più ricco del componente più volatile. Non si può separare l'alcol al 95% nei suoi componenti per distillazione frazionata perché in questop caso il vapore ha esattamente la stessa composizione del liquido: l'alcol a 95% , nella distillazione, si comporta come un composto puro.
Prende il nome di azeotropo o miscela a punto di ebollizione costante una miscela liquida avente la proprietà di fornire un vapore di composizione uguale. Dato che contiene due componenti, l'alcol a 95% è un azeotropo binario.
La maggior parte delle miscele azeotropiche, come l'alcol a 95% hanno punti di ebollizione inferiori a quelli dei loro componenti e sono noti come azeotropi a punto di ebollizione minimo; esisteno però anche miscele che bollono a temperature superiori a quelle dei loro componenti e sono note come azeotropi a punto di ebollizione massimo.
| 8 | |||||||||
Marcello Guidotti, copyright 2004
questa pagina può essere riprodotta su qualsiasi supporto o rivista purché sia citata la fonte e l'indirizzo di questo sito (ai sensi degli artt. 2575 e 2576 cc. Legislazione sul diritto d'autore). Le fotografie sono tratte da siti web e sono, o possono ritenersi, di pubblico dominio purché utilizzate senza fini di lucro. Le immagini di prodotti presenti nel sito hanno unicamente valenza esemplificativa oltre che, eventualmente, illustrare messaggi fuorvianti e non vi è alcun richiamo diretto o indiretto alla loro qualità e/o efficacia il cui controllo è affidato alle autorità regolamentatorie.