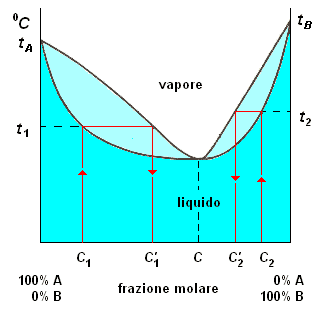
soluzioni che presentano sensibili deviazioni dalla legge di Raoult
La discussione che segue prende le mosse dall'analisi di una miscela formata da due liquidi A e B, completamente miscibili fra loro, della quale si è tracciato sperimentalmente un diagramma nel quale vengono riportati, per ogni composizione della soluzione A + B, il valore della temperatura di ebollizione e la composizione del vapore a tale temperatura.
In realtà, il comportamento delle soluzioni composte da due liquidi completamente miscibili tra loro, si discosta anche significativamente da quello ideale. In particolare, possono verificarsi due casi:
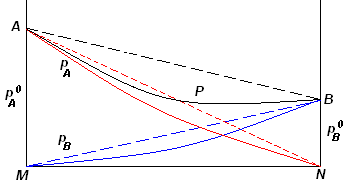
deviazioni negative dal comportamento ideale
|
l'interazione tra i liquidi A e B è tale che le loro singole molecole interagiscono tra loro (con legami dipolari, legami idrogeno) dando luogo a interazioni più forti di quelle presenti nei singoli liquidi puri.
Riportando su un diagramma le pressioni parziali in ordinate, e in ascisse le composizioni molari delle miscele possibili, risulta che le pressioni parziali sono inferiori a quelle teoriche (rappresentate con delle rette) e dunque, a temperatura costante, le pressioni verranno visualizzate con ordinate di altezza inferiore.
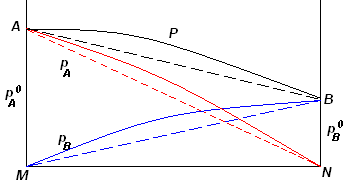
deviazioni positive dal comportamento ideale |
l'interazione tra i liquidi A e B è tale che le loro singole molecole interagiscono tra loro (allontanamento per diluizione tra le singole molecole omologhe) dando luogo a interazioni più deboli di quelle presenti nei singoli liquidi puri.
Riportando su un diagramma le pressioni parziali in ordinate, e in ascisse le composizioni molari delle miscele possibili, risulta che le pressioni parziali sono maggiori di quelle teoriche (rappresentate con delle rette) e dunque, a temperatura costante, le pressioni verranno visualizzate con ordinate di altezza maggiore.
deviazioni negative dalla legge di Raoult
Nel diagramma a destra in basso, la curva del liquido è il luogo dei punti che rappresentano le temperature di ebollizione corrispondenti alle diverse concentrazioni delle soluzioni A + B; la curva del vapore è il luogo dei punti che rappresentano la composizione del vapore delle predette soluzioni alle rispettive temperature di ebollizione.
Al di sotto della linea liquido è stabile soltanto la fase vapore, e nelle zone comprese fra le due curve coesistono liquido e vapore in un equilibrio caratteristico di ciascuna temperatura.
In corrispondenza di una particolare composizione, c, per la quale alla temperatura di ebollizione, soluzione e vapore hanno la stessa presenza percentuale, il diagramma presenta un punto di massimo: per tale composizione, il distillato ha la stessa composizione del residuo.
Quando il liquido che distilla ha la stessa composizione della soluzione da cui deriva, si ha una soluzione azeotropica (dal greco azéotrope = senza cambiamento).
 Il fatto che un liquido distilli inalterato è caratteristico dei composti puri; tuttavia, nel caso delle soluzioni azeotropiche non siamo in presenza di un composto stabile fra molecole A e B in quanto variando la pressione a cui avviene la distillazione, varia la temperatura ed anche la composizione della soluzione azeotropica. Al contrario, nel caso dei composti puri, la variazione di pressione influenza unicamente la temperatura di ebollizione, e non la composizione del distillato.
Il fatto che un liquido distilli inalterato è caratteristico dei composti puri; tuttavia, nel caso delle soluzioni azeotropiche non siamo in presenza di un composto stabile fra molecole A e B in quanto variando la pressione a cui avviene la distillazione, varia la temperatura ed anche la composizione della soluzione azeotropica. Al contrario, nel caso dei composti puri, la variazione di pressione influenza unicamente la temperatura di ebollizione, e non la composizione del distillato.
 Esaminiamo, seguendo il diagramma, il comportamento di una soluzione A + B di composizione diversa da c. Considereremo separatamente il comportamento di soluzioni le cui concentrazioni sono a sinistra o a destra di della concentrazione, c , per la quale si ha l'azeotropo.
Esaminiamo, seguendo il diagramma, il comportamento di una soluzione A + B di composizione diversa da c. Considereremo separatamente il comportamento di soluzioni le cui concentrazioni sono a sinistra o a destra di della concentrazione, c , per la quale si ha l'azeotropo.
composizioni a sinistra del punto azeotropico: consideriamo, ad esempio, la soluzione di composizione c1: essa bolle alla temperatura t1, ed il vapore, di composizione c'1, contiene il componente A (più volatile) in percentuale maggiore rispetto alla soluzione.
Con il procedere della distillazione, aumenta la temperatura di ebollizione del residuo in quanto diminuisce il suo contenuto di componente A (più volatile); pertanto il residuo si arricchisce progressivamente di B fino a raggiungere la composizione azeotropica c alla quale corrisponde una temperatura di ebollizione t. Da questo punto, il residuo e il distillato hanno la stessa composizione. Prima di raggiungere la composizione azeotropica, poiché il vapore distillato è più ricco in A della soluzione, è possibile - condensando e distillando più volte successivamente - ottenere un distillato costituito da A praticamente puro ed un residuo costituito da soluzione azeotropica.
Pertanto, per distillazione di una soluzione A + B con concentrazione a sinistra di del punto azeotropico si può ottenere A quasi puro (distillato) e miscela azeotropica (residuo), ma non i due componenti, quesi puri, A e B separatemante.
composizioni a destra del punto azeotropico: con un ragionamento analogo al precedente, si conclude che per distillazione di soluzioni A + B di composizione a destra di c, ad es., c2, si ottiene miscela azeotropica come residuo e liquido B quasi puro come distillato.
deviazioni positive dalla legge di Raoult
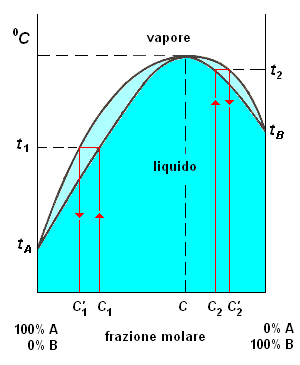
Il diagramma successivo mostra una deviazione positiva dalla legge di Raoult. La sua discussione non comporta differenze significative rispetto a quanto detto in predcedenza.
Esiste una composizione c della soluzione A + B, per la quale, alla temperatura di ebollizione, soluzione e vapore hanno la stessa composizione e distilla una soluzione azeotropica.
La distillazione di una soluzione A + B di composizione diversa da c si svolge analogamente a quanto visto nel caso precedente, in modo diverso a seconda della composizione iniziale.
composizione a sinistra del punto azeotropico: al procedere della distillazione il residuo si arricchisce in A fino ad essere costituito da A quasi puro; il vapore, per successive condensazioni e distillazioni, porta anch'esso ad A quasi puro come residuo ed a soluzione azeotropica come distillato.
composizione a destra del punto azeotropico: alla fine della distillazione il residuo è costituito da B; il vapore, per successive condensazioni e distillazioni, porta anch'esso a B quasi puro come residuo ed a soluzione azeotropica come distillato.
riassunto generale
- se la soluzione segue almeno approssimativamente la legge di Raoult, può essere separata quantitativamente nei liquidi A e B quasi puri per successive distillazioni.
- se la soluzione presenta deviazioni negative dalla legge di Raoult è possibile ottenere quasi puro, come distillato, il componente che è presente nella soluzione di partenza in concentrazione maggiore che nella soluzione azeotropica, e quest'ultima come residuo.
- se la soluzione presenta deviazioni positive dalla legge di Raoult è possibile ottenere quasi puro, come residuo della distillazione, il componente che è presente nella soluzione di partenza in concentrazione maggiore che nella soluzione azeotropica, e quest'ultima come distillato.
 1 1 |
 2 2 |
 3 3 |
 4 4 |
 5 5 |
 6 6 |
7 |
 8 8 |
 9 9 |
 10 10 |
 HOME PAGE HOME PAGE |
Marcello Guidotti, copyright 2004
questa pagina può essere riprodotta su qualsiasi supporto o rivista purché sia citata la fonte e l'indirizzo di questo sito (ai sensi degli artt. 2575 e 2576 cc. Legislazione sul diritto d'autore). Le fotografie sono tratte da siti web e sono, o possono ritenersi, di pubblico dominio purché utilizzate senza fini di lucro. Le immagini di prodotti presenti nel sito hanno unicamente valenza esemplificativa oltre che, eventualmente, illustrare messaggi fuorvianti e non vi è alcun richiamo diretto o indiretto alla loro qualità e/o efficacia il cui controllo è affidato alle autorità regolamentatorie.


 Il fatto che un liquido distilli inalterato è caratteristico dei composti puri; tuttavia, nel caso delle soluzioni azeotropiche non siamo in presenza di un composto stabile fra molecole A e B in quanto variando la pressione a cui avviene la distillazione, varia la temperatura ed anche la composizione della soluzione azeotropica. Al contrario, nel caso dei composti puri, la variazione di pressione influenza unicamente la temperatura di ebollizione, e non la composizione del distillato.
Il fatto che un liquido distilli inalterato è caratteristico dei composti puri; tuttavia, nel caso delle soluzioni azeotropiche non siamo in presenza di un composto stabile fra molecole A e B in quanto variando la pressione a cui avviene la distillazione, varia la temperatura ed anche la composizione della soluzione azeotropica. Al contrario, nel caso dei composti puri, la variazione di pressione influenza unicamente la temperatura di ebollizione, e non la composizione del distillato.
 Esaminiamo, seguendo il diagramma, il comportamento di una soluzione A + B di composizione diversa da c. Considereremo separatamente il comportamento di soluzioni le cui concentrazioni sono a sinistra o a destra di della concentrazione, c , per la quale si ha l'azeotropo.
Esaminiamo, seguendo il diagramma, il comportamento di una soluzione A + B di composizione diversa da c. Considereremo separatamente il comportamento di soluzioni le cui concentrazioni sono a sinistra o a destra di della concentrazione, c , per la quale si ha l'azeotropo.