miscele di liquidi totalmente miscibili
Consideriamo una soluzione formata da due liquidi A e B. Il vapore in equilibrio con la soluzione (liquido A + liquido B) è costituito dal vapore di A e dal vapore di B. In generale, la composizione percentuale del liquido e quella del vapore sono differenti in quanto sono differenti le tensioni di vapore di A e B puri.
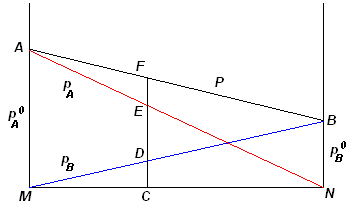 Se la composizione della soluzione avesse un comportamento ideale (più avanti discuteremo le soluzioni reali), la sua pressione di vapore, P, alla temperatura, T, sarebbe data dalla somma delle pressioni di vapore parziali di A e B. Per esempio, la pressione di una miscela di composizione C, ha una pressione Pc data dalla somma delle due pressioni parziali:
Se la composizione della soluzione avesse un comportamento ideale (più avanti discuteremo le soluzioni reali), la sua pressione di vapore, P, alla temperatura, T, sarebbe data dalla somma delle pressioni di vapore parziali di A e B. Per esempio, la pressione di una miscela di composizione C, ha una pressione Pc data dalla somma delle due pressioni parziali:
Pc = PFC = pDC + pEC
infatti, FC = DC + EC in quanto DC = FE perché appartenenti a due triangoli ABN e BMN che hanno la stessa base, BN, e la stessa altezza, MN.
considerando che nella soluzione le pressioni di vapore sono quelle che avrebbero i singoli componenti puri, pA0 e pB0, però ridotte in funzione delle rispettive frazioni molari in soluzione, si ha:
PC = pB0 · nB/(nA+ nB) + pA0 · nA/(nA+ nB)
il processo di evaporazione
Supponiamo di riscaldare una miscela di composizione M, costituita da due liquidi miscibili, A e B, contenuti in un recipiente munito di pistone mobile, in modo che la pressione si mantenga costante ed il vapore non si disperda nell'ambiente.
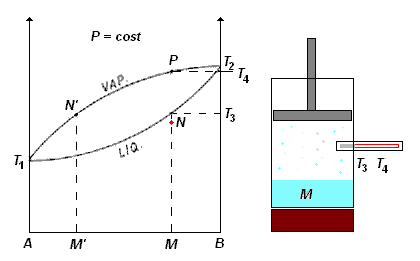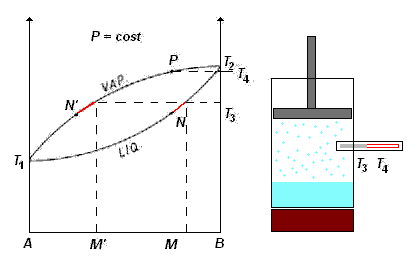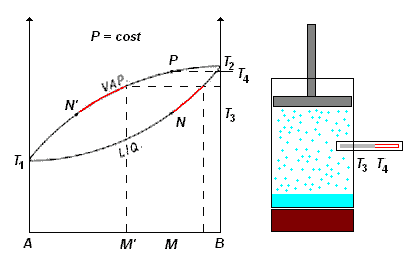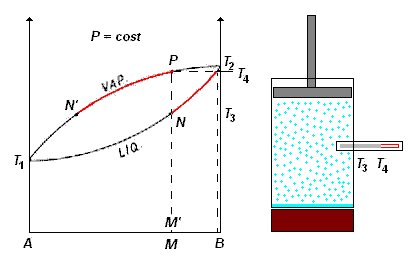 Osservando l'animazione a destra, si vede chiaramente che quando il termometro nel cilindro indica la temperatura T3 , la miscela inizierà a bollire (il pallino rosso sul diagramma raggiunge il punto N : temperatura T3) ed il vapore emesso - essendo alla stessa temperatura del liquido - ha la composizione M' (calcolata graficamente conducendo dal punto N - sulla curva del liquido - una retta parallela all'asse delle x fino ad incontrare - sulla curva del vapore - il punto N' , e poi abbassando da questo punto la verticale sulle ascisse)
Osservando l'animazione a destra, si vede chiaramente che quando il termometro nel cilindro indica la temperatura T3 , la miscela inizierà a bollire (il pallino rosso sul diagramma raggiunge il punto N : temperatura T3) ed il vapore emesso - essendo alla stessa temperatura del liquido - ha la composizione M' (calcolata graficamente conducendo dal punto N - sulla curva del liquido - una retta parallela all'asse delle x fino ad incontrare - sulla curva del vapore - il punto N' , e poi abbassando da questo punto la verticale sulle ascisse)
La miscela liquida, avendo liberato in quantità maggiore il componente A (più volatile), diverrà più concentrata nel componente B e quindi la sua temperatura di ebollizione aumenterà.
Pertanto, è ovvio che la temperatura di ebollizione della miscela andrà continuamente aumentando (spostandosi lungo la linea del liquido, a partire dal punto N) fino a che il liquido residuo (sempre più concentrato nel componente B) avrà raggiunto una composizione tale che il suo vapore (la cui composizione si sposta lungo la linea del vapore) abbia la stessa composizione M del liquido di partenza (v. punto P del diagramma): questo accade alla temperatura T4, e pertanto a questa temperatura terminerà l'ebollizione in quanto tutto il liquido è trasformato in vapore.
Questo semplice esperimento dimostra che le miscele di due liquidi non hanno una temperatura di ebollizione, ma un intervallo di ebollizione; in questo caso, compreso tra
T3 e T4.
distillazione
Le miscele di due liquidi miscibili, in realtà, non vengono vaporizzate nel modo discusso, in quanto lo scopo è separare un componente dall'altro: questo risultato si ottiene allontanando il vapore emesso dal componente più volatile, eseguendo cioé una distillazione semplice o discontinua.
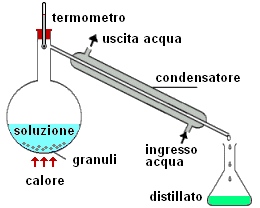
distillatore semplice (modificato da: www.wpbschoolhouse.btinternet.co.uk) |
La distillazione semplice comprende due stadi ed entrambi riguardano cambiamenti di stato fisici. L'apparecchio utilizzato, è essenzialmente un alambicco con l'aggiunta di un condensatore (scambiatore di calore) che ne migliora l'efficienza.
- La miscela o soluzione liquida è bollita per vaporizzare i componenti più volatili nella miscela. L'aggiunta di granuli solidi depositati sul fondo, unitamente ad un'attenta regolazione del flusso di calore riscaldante, favorisce un'ebollizione omogenea. Infatti, un'ebollizione tumultuosa può favorire la presenza nel "cuore" di composti altobollenti che vengono trascinati dai vapori caldi.
- Il vapore è raffreddato da acqua fredda nel condensatore in modo da liquefarlo e raccoglierlo in un recipiente.
 |
|
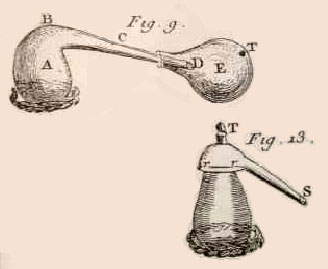 |
| alambicco distillatore in rame con caldaia a sfera da 3.000 cc (prodotto da Arrigo De Gasperi). Il componente più volatile esce per primo dal tubicino. |
|
alambicchi in vetro utilizzati dagli alchimisti. |
Questo processo può essere utilizzato per purificare l'acqua poiché i componenti solidi disciolti hanno un punto di ebollizione più alto e quindi non evaporano insieme al vapore. Tuttavia, questo metodo è scarsamente efficiente per separare una miscela di liquidi, particolarmente se i loro punti di ebollizione sono abbastanza vicini tra loro.
scambiatore di calore
Gli scambiatori di calore sono sistemi aperti adibiti al trasferimento di energia, sotto forma di calore, tra due fluidi a diversa temperatura. Lo scambio termico avviene grazie ad una parete di vetro o metallica che separa i due fluidi.
Il condensatore inserito nel distillatore per aumentare l'efficacia della distillazione, prevede che il liquido di raffreddamento in ingresso (l'acqua) fluisca nel verso opposto del distillato. Questo precesso definisce uno scambiatore di calore in controcorrente; al contrario, quando il liquido refrigerante fluisce nello stesso verso del distillato (o del liquido da reffreddare) si ha uno scambiatore in equicorrente.
La principale differenza fra i due tipi di scambiatore, è riassunta dai grafici in basso.
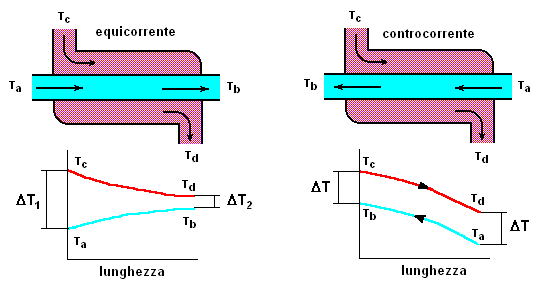
Si deve notare che nello scambiatore in equicorrente si ha un salto termico notevole all'inizio del processo, e la differenza di temperatura dei due fluidi si attenua lungo il percorso fino a portarsi all'equilibrio. Questo fatto è importante quando per es. il liquido da distillare deve ricadere nel recipiente riscaldato in modo da concentrarsi (v. soxhlet). Al contrario, quando lo scambiatore è in controcorrente, la differenza di temperatura fra i due fludi si mantiene pressocché costante e questo è apprezzato nella distillazione.
dissalazione dell'acqua mediante distillazione
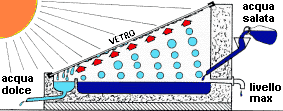 Uno dei problemi che affliggono molte popolazioni, è la mancanza di acqua o la sua poca disponibilità. Ci sono luoghi della Terra dove le falde acquifere sono difficilmente raggiungibili e l'unica acqua disponibile è quella salmastra.
Uno dei problemi che affliggono molte popolazioni, è la mancanza di acqua o la sua poca disponibilità. Ci sono luoghi della Terra dove le falde acquifere sono difficilmente raggiungibili e l'unica acqua disponibile è quella salmastra.
In questo caso, si può facilmente cotruire con pochi mezzi, come mostra lo schema a destra, un distillatore per ottenere picccole piccole quantità d'acqua. L'acqua che esce questa unità è distillata per cui, per renderla bevibile è necessario aggiungere una piccola parte di acqua salata e travasarla due o tre volte in un altro recipiente in modo da aumentarne l'ossigenazione.
aspetti teorici della distillazione semplice
Supponiamo di portare ad ebollizione una miscela di composizione C1, costituita da 50% di A e 50% di B (Fig. 1). Il vapore liberato dal liquido in ebollizione sarà più ricco nel componente più volatile, B, che bolle a temperatura inferiore, ed avrà la composizione C2.
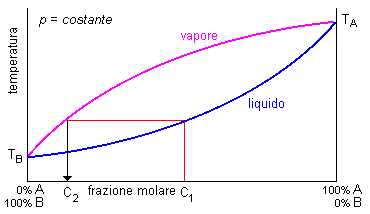
Fig. 1 - alla composizione del liquido letta nella curva inferiore, corrisponde la composizione del vapore letta sulla curva superiore. Nella zona fra le due cuve si può leggere la composizione della miscela. |
In pratica, il vapore risale lungo il tubo distillatore e attraversando lo scambiatore di calore viene raffreddato e condensa gocciolando in un adatto recipiente di raccolta.

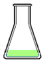
Il vapore condensato (distillato) di composizione C2, supponiamo pari a 12% A e 88% B, viene raccolto in una beuta. Su questo condensato è possibile ripetere la distillazione in modo da ottenere una maggior purezza del componente più volatile.
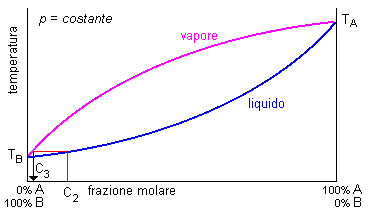 |
| Fig. 2 - un secondo processo distillativo a partire da una miscela di composizione C2, produce un distillato arricchito nel componente più volatile rispetto alla quantità ottenuta dalla distillazione precedente. |

Da quanto discusso, è facile comprendere che, a meno di situazioni in cui i due composti abbiano punti di ebollizione molto diversi (almeno una sessantina di gradi), la distillazione semplice non è un metodo efficace per separare due composti volatili, poiché le frazioni raccolte sono sempre costituite da miscele dei due componenti, sia pure più o meno arricchite in uno o l'altro dei due.
volatilità relativa
La volatilità relativa è una misura della differenza di volatilità tra 2 componenti, e quindi dei loro punti di ebollizione. Essa indica la facilità o la difficoltà di una determinata separazione. La volatilità relativa del componente "i" rispetto al componente "j" è definita come:
aij = (yi/xi)/(yj/xj)
yi = frazione molare del componente "i" nel vapore
xj = frazione molare del componente "j" nel liquido
Così, se la volatilità relativa tra due componenti è molto vicina a 1, ciò indica che essi hanno tensioni di vapore molto simili. Questo comporta che essi hanno punti di ebollizione simili e pertanto sarà difficile separare i due componenti mediante distillazione.
 1 1 |
 2 2 |
 3 3 |
 4 4 |
5 |
 6 6 |
 7 7 |
 8 8 |
 9 9 |
 10 10 |
 HOME PAGE HOME PAGE |
Marcello Guidotti, copyright 2004-2005
questa pagina può essere riprodotta su qualsiasi supporto o rivista purché sia citata la fonte e l'indirizzo di questo sito (ai sensi degli artt. 2575 e 2576 cc. Legislazione sul diritto d'autore). Le fotografie sono tratte da siti web e sono, o possono ritenersi, di pubblico dominio purché utilizzate senza fini di lucro. Le immagini di prodotti presenti nel sito hanno unicamente valenza esemplificativa oltre che, eventualmente, illustrare messaggi fuorvianti e non vi è alcun richiamo diretto o indiretto alla loro qualità e/o efficacia il cui controllo è affidato alle autorità regolamentatorie.
 Se la composizione della soluzione avesse un comportamento ideale (più avanti discuteremo le soluzioni reali), la sua pressione di vapore, P, alla temperatura, T, sarebbe data dalla somma delle pressioni di vapore parziali di A e B. Per esempio, la pressione di una miscela di composizione C, ha una pressione Pc data dalla somma delle due pressioni parziali:
Se la composizione della soluzione avesse un comportamento ideale (più avanti discuteremo le soluzioni reali), la sua pressione di vapore, P, alla temperatura, T, sarebbe data dalla somma delle pressioni di vapore parziali di A e B. Per esempio, la pressione di una miscela di composizione C, ha una pressione Pc data dalla somma delle due pressioni parziali:
 Osservando l'animazione a destra, si vede chiaramente che quando il termometro nel cilindro indica la temperatura T3 , la miscela inizierà a bollire (il pallino rosso sul diagramma raggiunge il punto N : temperatura T3) ed il vapore emesso - essendo alla stessa temperatura del liquido - ha la composizione M' (calcolata graficamente conducendo dal punto N - sulla curva del liquido - una retta parallela all'asse delle x fino ad incontrare - sulla curva del vapore - il punto N' , e poi abbassando da questo punto la verticale sulle ascisse)
Osservando l'animazione a destra, si vede chiaramente che quando il termometro nel cilindro indica la temperatura T3 , la miscela inizierà a bollire (il pallino rosso sul diagramma raggiunge il punto N : temperatura T3) ed il vapore emesso - essendo alla stessa temperatura del liquido - ha la composizione M' (calcolata graficamente conducendo dal punto N - sulla curva del liquido - una retta parallela all'asse delle x fino ad incontrare - sulla curva del vapore - il punto N' , e poi abbassando da questo punto la verticale sulle ascisse)




 Uno dei problemi che affliggono molte popolazioni, è la mancanza di acqua o la sua poca disponibilità. Ci sono luoghi della Terra dove le falde acquifere sono difficilmente raggiungibili e l'unica acqua disponibile è quella salmastra.
Uno dei problemi che affliggono molte popolazioni, è la mancanza di acqua o la sua poca disponibilità. Ci sono luoghi della Terra dove le falde acquifere sono difficilmente raggiungibili e l'unica acqua disponibile è quella salmastra. 

